欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
[color=rgba(0, 0, 0, 0.85)]本篇文章旨在为大家介绍医疗器械产品注册基础知识,相信大家都听过注册证,那么大家是否知道注册证是怎么申请下来的呢?申请前又需要做哪些准备工作呢?一起来学习下吧~ [color=rgba(0, 0, 0, 0.85)]什么是医疗器械注册 [color=rgba(0, 0, 0, 0.85)]根据《医疗器械注册管理办法》第三条:医疗器械注册是食品药品监督管理部门根据医疗器械注册申请人的申请,依照法定程序,对其拟上市医疗器械的安全性、有效性研究及其结果进行系统评价,以决定是否同意其申请的过程。 [color=rgba(0, 0, 0, 0.85)]医疗器械备案是医疗器械备案人向食品药品监督管理部门提交备案资料,食品药品监督管理部门对提交的备案资料存档备查。 [color=rgba(0, 0, 0, 0.85)]我们国家是依据风险程度对医疗器械进行分类管理划分为一类、二类、三类,一类医疗器械只需在药监局备案管理,不需要审批,二、三类产品需要注册审批。 [color=rgba(0, 0, 0, 0.85)]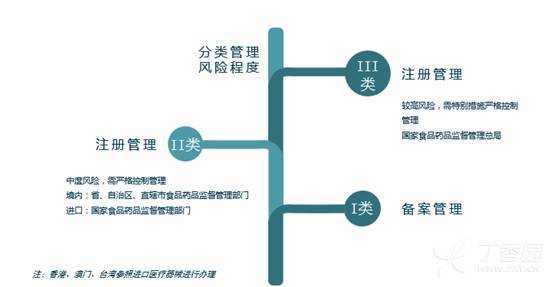 [color=rgba(0, 0, 0, 0.85)]医疗器械产品注册流程(首次注册) [color=rgba(0, 0, 0, 0.85)](1)确定分类与主管机构 [color=rgba(0, 0, 0, 0.85)]可依据2017年9月4日正式发布新修订的《医疗器械分类目录》进行产品分类判断,该分类目录自2018年8月1日起实施。一类产品在对应药监局局备案即可(进口的要到国家局备案);二类产品需要到省局注册;三类产品需要到国家局注册。那么如果新研制的产品不在分类目录里面呢?依据《医疗器械监督管理条例》第十六条:对新研制的尚未列入分类目录的医疗器械,申请人可以依照本条例有关第三类医疗器械产品注册的规定直接申请产品注册,也可以依据分类规则判断产品类别并向国务院食品药品监督管理部门申请分类界定后,依照本条例的规定申请注册(二、三类)或者进行产品备案(一类)。 [color=rgba(0, 0, 0, 0.85)](2)基础准备+检测 [color=rgba(0, 0, 0, 0.85)]在产品基本定型以后要进行产品技术要求编写,当然,也可以提前着手,同时确保待测品的生产符合医疗器械质量管理体系相关要求,同时具备典型性,然后可以进行内部自测,一类备案产品,只需提供自测合格报告即可,二、三类产品在自测达到技术要求规定后送到检测机构进行注册检测,一般需要准备样品、试验合同、说明书和产品技术要求,具体依据各检测机构网站公布的送检要求执行,同时要求检测机构具备医疗器械检验资质同时具备送检样品的承检范围,检测机构出具的合格检测报告是后续注册申报和启动临床试验的必备资料。 [color=rgba(0, 0, 0, 0.85)]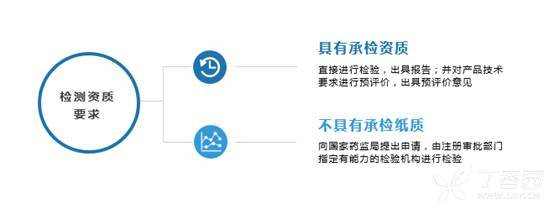 [color=rgba(0, 0, 0, 0.85)] [color=rgba(0, 0, 0, 0.85)]检测包括检测哪些项目、检测方法以及合格性判据,不同产品即使检测同一项目也可能有不同的合格性判据或标准要求。常见的有源医疗器械检测包括产品性能、电磁兼容、电气安全、环境试验等,注册检验的话报告后面会有检测机构对技术要求进行的一个预评价,即技术要求中的检测项目、检测方法判断是否充分,若无补充则如下图,若不足之处则会指出对应哪里不足 [color=rgba(0, 0, 0, 0.85)] [color=rgba(0, 0, 0, 0.85)] [color=rgba(0, 0, 0, 0.85)]这里要注意的是产品技术要求非常重要,定的过高或过低都可能会给企业带来不必要的麻烦,为什么这么说呢?如果技术要求定的过高,无疑生产成本增加,后续变更也会更困难,上市后抽样可能无法保持稳定性而不合格继而引发一些列问题;定的过低的话,很可能在审评阶段会被发补,无论是重做或者增加检测项目都会影响注册周期,尤其是长期检测的项目会严重影响产品上市步伐。 [color=rgba(0, 0, 0, 0.85)] [color=rgba(0, 0, 0, 0.85)](3)临床评价 [color=rgba(0, 0, 0, 0.85)]医疗器械临床评价是指申请人或者备案人通过临床文献资料、临床经验数据、临床试验等信息对产品是否满足使用要求或者适用范围进行确认的过程。 [color=rgba(0, 0, 0, 0.85)]哪些产品需要做临床试验呢?一类产品不需要进行临床试验;不在免试验目录范围内的二类三类产品通常需要进行临床试验;若新产品与已上市的产品在安全有效性方面没有差异,即已上市产品的临床试验结果能代表申报产品的结果,那么也不需要进行临床试验,但这往往需要取得同类器械企业的授权生产、使用临床数据方可。 [color=rgba(0, 0, 0, 0.85)] 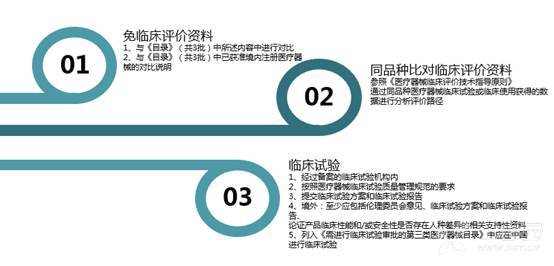 [color=rgba(0, 0, 0, 0.85)]I类:不需要临床 [color=rgba(0, 0, 0, 0.85)]II类、III类需要临床试验,免临床目录中产品、通过同品种比对产品除外 [color=rgba(0, 0, 0, 0.85)] [color=rgba(0, 0, 0, 0.85)]1)免临床目录:II类、III类产品(共3批) [color=rgba(0, 0, 0, 0.85)]2)III类高风险需要国家食品药品监督管理总局审批: [color=rgba(0, 0, 0, 0.85)]时限要求:受理3个工作日,技术审评40个工作日,决定20个工作日;如需补正资料,补正时间1年,技术再审评40个工作日; [color=rgba(0, 0, 0, 0.85)]撤销申请情形: [color=rgba(0, 0, 0, 0.85)]申报资料虚假; [color=rgba(0, 0, 0, 0.85)]已有最新研究证实原批准结果在伦理性和科学性上存在问题; [color=rgba(0, 0, 0, 0.85)]其他情形; [color=rgba(0, 0, 0, 0.85)]批件有效期:3年;过期重新申请 [color=rgba(0, 0, 0, 0.85)] 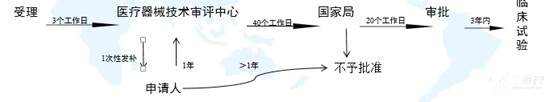 [color=rgba(0, 0, 0, 0.85)] [color=rgba(0, 0, 0, 0.85)]在检测机构完成对产品的注册检测后,企业就可以用检测报告递交开展临床试验。值得注意的是,目前法规规定检测报告必须在一年内启动临床试验。 [color=rgba(0, 0, 0, 0.85)]医疗器械的临床试验,特别是高风险器械往往占据整个开发成本的60%-80%,临床实验要经过严格的病人招募、长期的随访、数据管理及统计报告等,往往需要三到五年的时间才能完成临床试验。所以临床试验的结果直接影响到产品是否能够得到审批、间接的所有投入是否能够取得回报。 [color=rgba(0, 0, 0, 0.85)] 临床试验资料包括医生签署的合同,伦理批件,知情同意书,临床试验方案和临床试验报告,这些资料需要递交给药监局进行审核。 [color=rgba(0, 0, 0, 0.85)] [color=rgba(0, 0, 0, 0.85)] [color=rgba(0, 0, 0, 0.85)]  [color=rgba(0, 0, 0, 0.85)]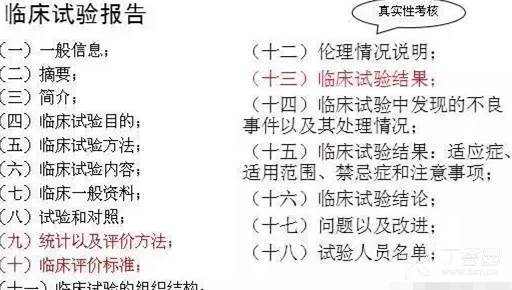 [color=rgba(0, 0, 0, 0.85)](4)注册资料准备与递交 [color=rgba(0, 0, 0, 0.85)]注册资料准备参考下图 [color=rgba(0, 0, 0, 0.85)] [color=rgba(0, 0, 0, 0.85)] [color=rgba(0, 0, 0, 0.85)]后续会分别介绍每一个资料应该如何编写及有哪些注意事项,在资料准备完毕后汇总提交到药监局,药监局接到受理文件后会进行初步的审查,随后送到技术审评部门进行技术审评工作。 [color=rgba(0, 0, 0, 0.85)]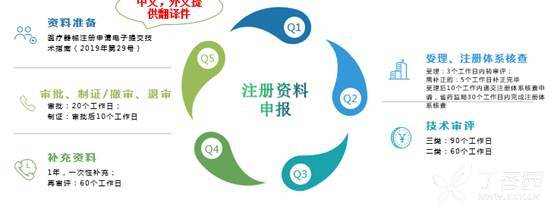 [color=rgba(0, 0, 0, 0.85)] [color=rgba(0, 0, 0, 0.85)]二类审评时长为60个工作日,三类审评时长为90个工作日,在此期间,可向企业所在省药监局申请注册体系现场考核,体系考核一般会有三种结果: [color=rgba(0, 0, 0, 0.85)]一是直接通过检查; [color=rgba(0, 0, 0, 0.85)]二是整改后复查; [color=rgba(0, 0, 0, 0.85)]三是体系考核发现严重安全隐患不通过检查。 [color=rgba(0, 0, 0, 0.85)]如果核查结论是“通过”,一般10个工作日内会出具通知,如果是“整改后复查”,企业需在6个月内提交整改报告和复查申请,还是于30个工作日内复查,复查通过的,会于10个工作日内将结果寄送审评中心,所以基本体系考核结束以后拿到考核报告的同时大致会收到药监局第一轮的发补意见。 [color=rgba(0, 0, 0, 0.85)] [color=rgba(0, 0, 0, 0.85)] 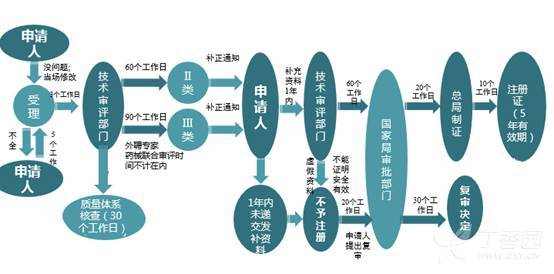 [color=rgba(0, 0, 0, 0.85)] 以上个人浅见,欢迎各位批评指正,也欢迎各位关注博客一起交流!
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033