欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
2023年12月,国家药监局修订了2014年发布的医疗器械GSP法规,从而更加符合目前的市场情况,加强医疗器械经营质量管理,规范医疗器械经营行为。本期将分享医疗器械GSP法规新旧版本的对比,希望对您的学习有帮助! 01 中国医疗器械GSP对比总览 医疗器械GSP法规两版本分别如下: (可点击法规查看原文) - 旧版本:2014年《医疗器械经营质量管理规范》(SFDA 2014年第58号)
- 新版本:2023年 《医疗器械经营质量管理规范》(NMPA 2023年第153号)
本规范在修订的总体思路上,主要围绕以下四点: - 与上位法保持一致
对与现行政策法规不相一致的内容进行修改,补充完善相关规定。 - 对突出问题的补充完善
以严控经营环节质量安全风险为导向,对监管部门与行业企业反映的突出问题进行针对性的补充,解决经营环节质量管理盲区,提高监管效能。 - “放管服”
深化推进“放管服”改革(即简政放权、放管结合、优化服务),促进医疗器械产业高质量发展,释放市场创新活力。 - 强化QMS,细化条款
通过强化质量管理体系要求,细化质量管理规范条款,明确落实企业各层级管理责任。
总体修订对比总览: 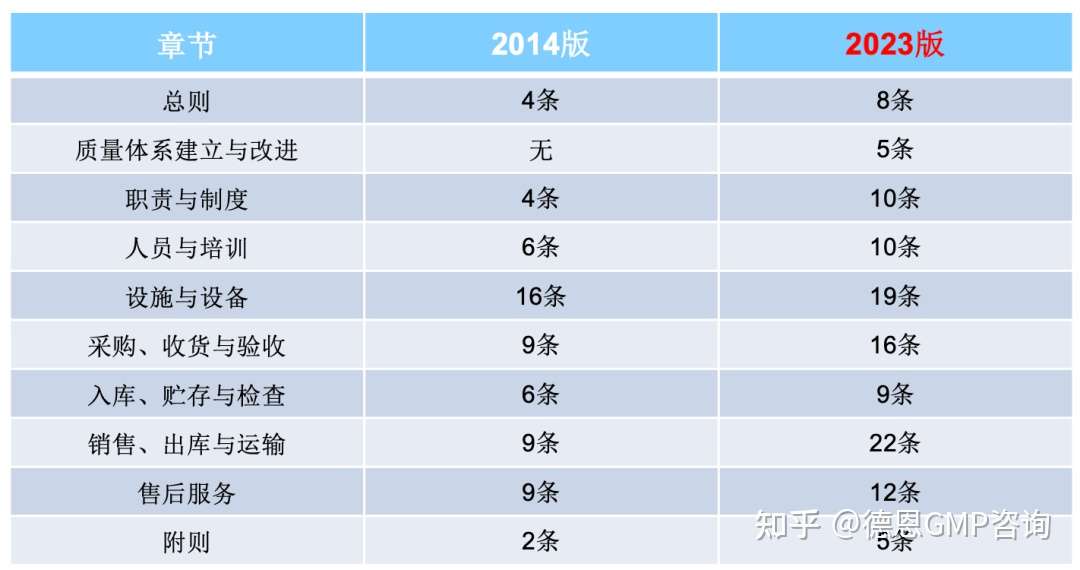 02 各章节的显著改变点 接下来,德恩主要分享各章节修订后的显著改变点。 1. 总则 - 强调可追溯性
第二条 本规范是医疗器械经营质量管理的基本要求。从事医疗器械经营活动,应当在医疗器械采购、验收、贮存、销售、运输、售后服务等全过程采取有效的质量管理措施,确保医疗器械产品在经营过程中的质量安全与可追溯。 - 鼓励信息化技术
第八条 鼓励企业运用先进的质量管理工具与方法实施质量管理,持续改进质量管理体系。鼓励企业数字化、智能化、绿色化发展,提升医疗器械供应链效率与质量安全,促进行业高质量发展。
2. 质量体系建立与改进 - 强调质量管理体系
旧-基本由质量管理机构或者质量管理人员参与质量活动。
新-新提出质量管理体系,要求全员参与质量管理,承担相应质量责任。 - 加强监督
第二类医疗器械也需要每年递交自查报告
3. 职责与制度 - 拔高并明确质量负责人的地位
“质量负责人为高层管理人员或者质量管理机构负责人”
“企业负责人作出涉及医疗器械质量安全的重大决策前,应当充分听取质量负责人、质量管理人员的意见和建议”
“企业负责人应当每季度至少听取一次质量负责人工作情况汇报” - 新增必需的质量体系文件
①质量安全关键岗位人员岗位说明
②质量文件审核批准管理制度、质量记录管理制度
③自查制度(旧版只要求第三类具备自查制度)
④在库检查管理
⑤有效期管理
⑥运输管理
⑦追溯管理
⑧质量安全风险会商管理
⑨采购、收货、验收、贮存、销售、出库、运输等环节的工作程序(可以初步理解为需要根据公司业务制定详细的SOP)
4. 人员与培训 - 明确必需的质量记录(伴随新增的质量体系文件)
①出库复核记录
②运输记录,冷链运输过程温度记录
③售后服务记录
④退货记录
⑤质量安全风险会商相关记录 - CS要求
使用计算机信息系统存储的质量记录,应当采用安全可靠的方式存储各类数据,定期备份并确保备份数据存储安全,防止损坏和丢失。
5. 设施与设备 - 增加自动售械机的要求
第四十七条 自动售械机作为医疗器械零售经营场所的延伸,其设置位置、数量等应当与企业的管理能力相适应。 - CS方面增加的要求
①依旧是要求第三类应当使用CS
②新增权限管理功能要求,保证数据可靠性,包括数据的录入、修改、保存以及部门/岗位之间传输
③新增对供货者资质有效期预警功能要求
④新增采集、记录MD唯一标识的功能要求
⑤新增数据自动备份功能要求
⑥明确第三类均需要具备外部业务和监管系统数据交互的接口 - 跨行政区域或委托销售的CS要求
与经营企业本部互联互通,实时交互贮存、出入库数据
6. 采购、收货与验收 - 供货者档案新增内容
①随货同行单样式(含样章)
②标签样稿或图片
③唯一标识(若有) - 鼓励采用电子格式储存收货过程运单和随货同行单据
- 新增冷链验收信息
①运输方式
②到货以及在途温度
③启运与到货时间
7. 入库、贮存与检查 - 明确入库记录信息
与进货查验记录相似 - 要求使用WMS的情况
第七十二条 从事专门提供医疗器械运输、贮存服务的企业,应当通过计算机信息系统有效区分其自营、受托,以及不同委托方的医疗器械。
8. 销售、出库与运输 - 明确委托销售的管理
委托协议 - 新增随货同行单与运输记录的内容要求
- 新增冷链运输过程应急措施要求
9. 售后服务
以上为德恩总结出的中国医疗器械GSP法规新旧版本的对比。如您喜欢,可关注德恩;或者点击“GMP资源”到德恩资源库中查看更多GMP法规相关的技术文章。
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033