欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
新的临床评价指导原则已经出了,我相信很多朋友都准备在十一的假期中好好学习和研读。 我们在工作中会遇到国内以及国外的企业客户。对于国内的客户,大部分会按照我们的指导和协助去准备相应的资料,而对于国外的客户,情况就会不同。 由于很多国外的客户,他们有EU的注册经验,FDA的注册经验,以及别的地区的注册经验,总会以先入为主的、带着一种莫名其妙的“优越感”的觉得他们的临床评价资料是充分的,合理的,然而通过无数次的实践证明,只有符合和遵守“当地”的法规要求,才是最“快”,最“高效”的。 因此我们尝试翻译、整理了一些东西,希望能够帮助国外的同事理解NMPA的临床评价要求,从而在启动注册的时候,能够更高效的准备好相应资料,让产品更快的上市。 如:医疗器械临床试验决策流程图
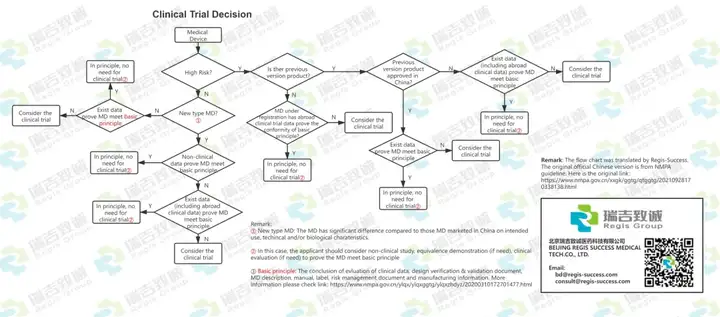
如:等同性论证流程图
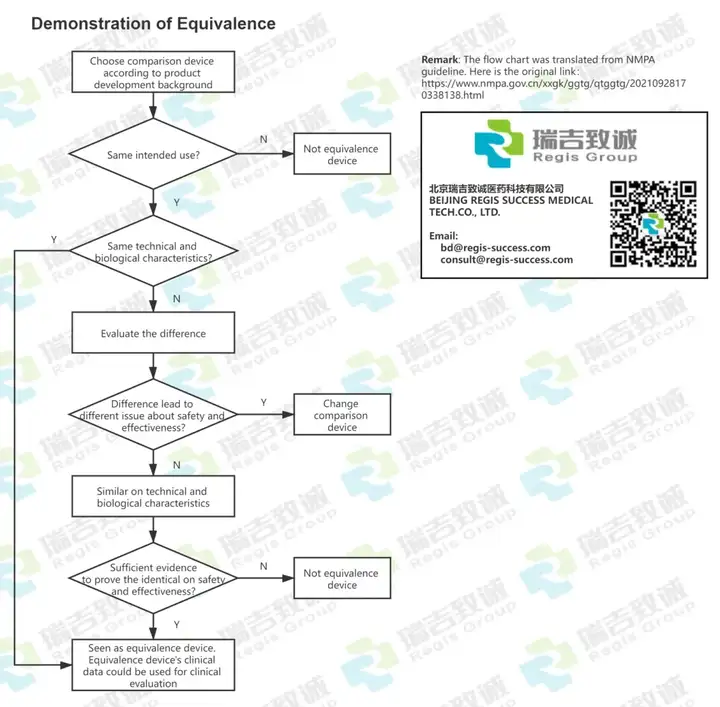
对于对比表,有中文的,也有英文的。当前仅仅是初稿,因为如果详细做的话,还可以分的更细,更直观一些。但当前的版本,作为初期让国内客户,以及国外客户了解要对比的东西,还是够用的。 中文的:
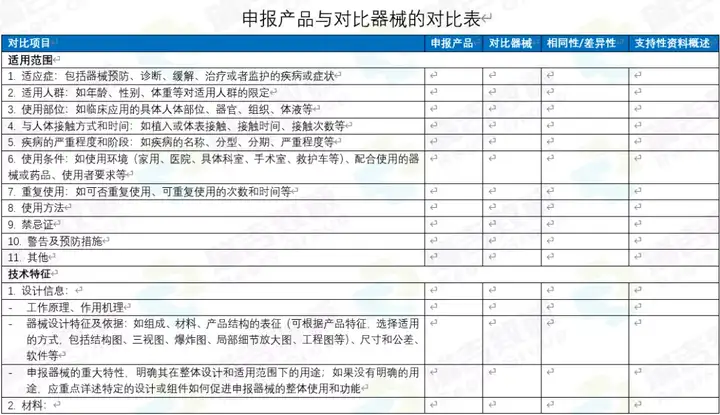
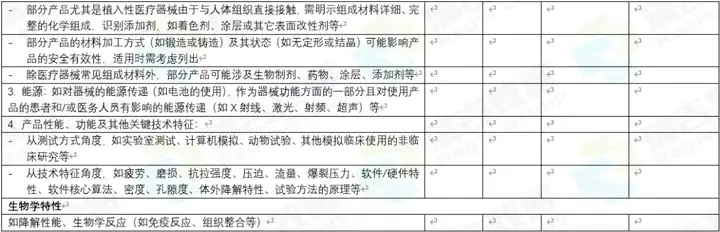
英文的:
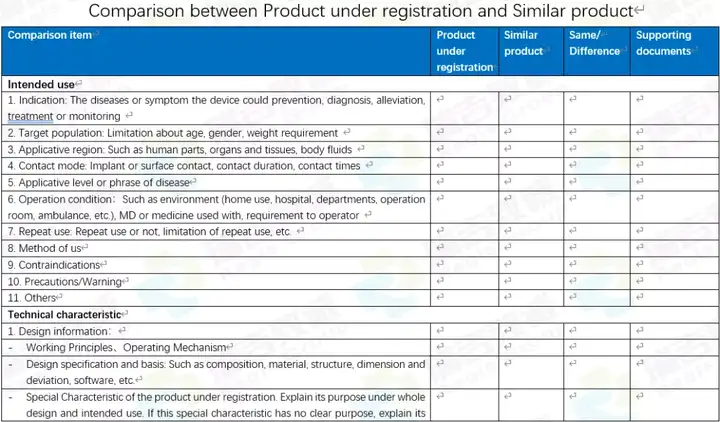
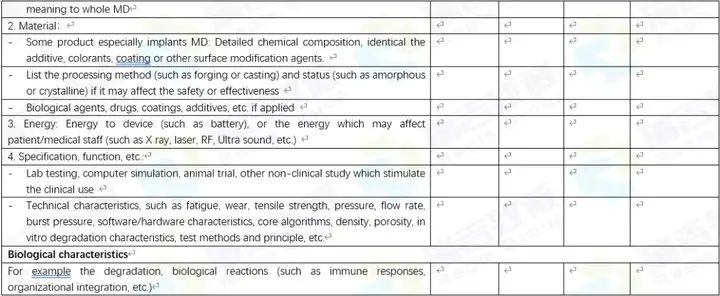
希望这几个资料也能对各位朋友有所帮助。如果有错误或不足,请您不吝赐教。
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033