欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
巴西ANVISA原料药注册Registro官方问答
登记原料药,比较简单,提交一些必要的文件即可。 而注册需要很复杂的流程,也需要2年以上的时间,管控一些需要特殊管理的原料药。 Regularização de Produtos – Insumos Registro de Insumos Farmacêuticos 产品法规, 原料药注册 1 流程如何 第一步: 公司许可获得 第二步:确定注册种类和需求 第三步:提交注册 第四步: ANVISA审核 第五步: 官方日报公布注册结果 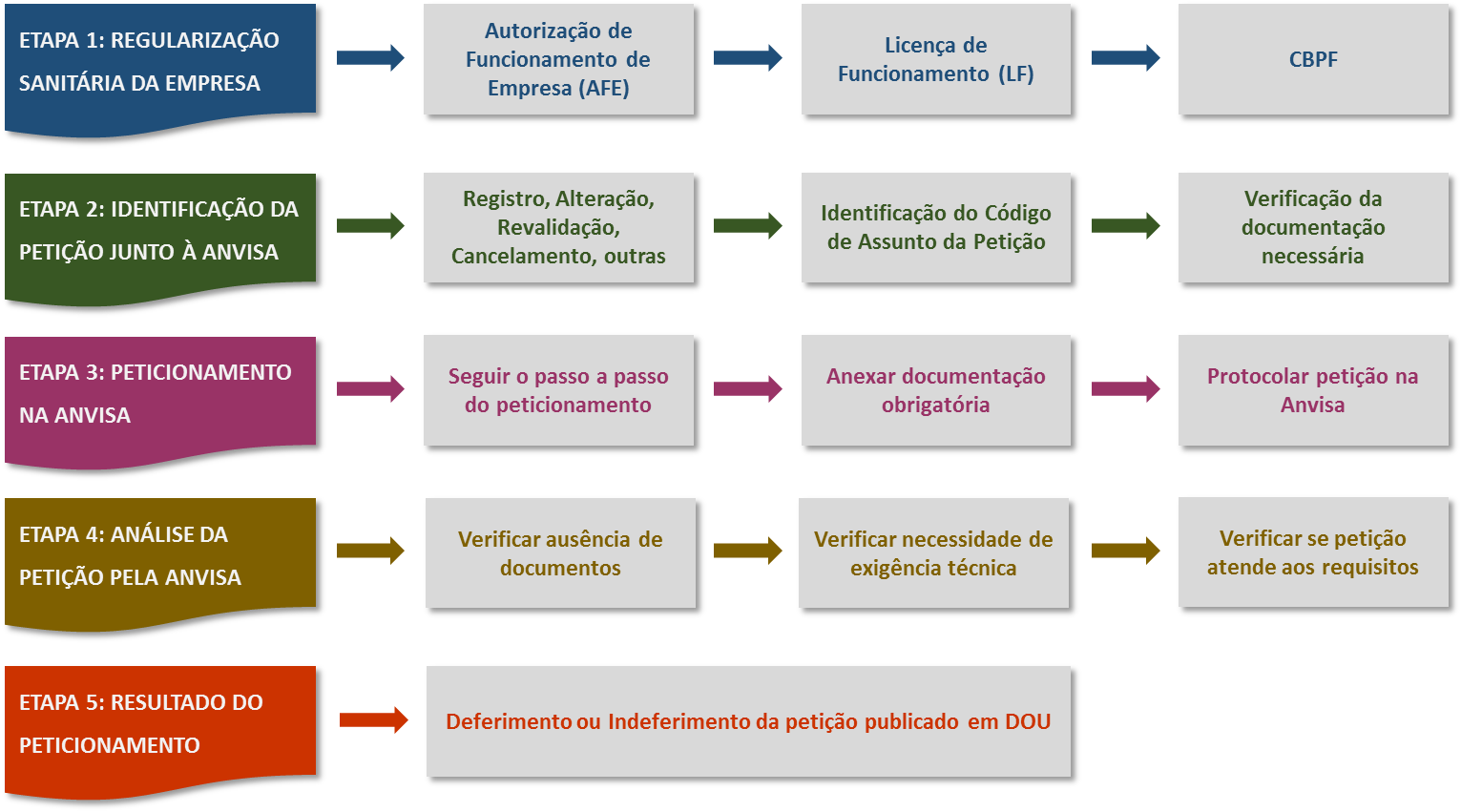
2. 注册所参照的法规? 参照RDC 57/2009办法 A norma da Anvisa que dispõe sobre o registro de Insumos Farmacêuticos Ativos é a RDC no 57/2009. 3. 原料药需要注册码? 是的。根据RDC 57/2009办法, 再注册期限以后,原料药不能进口、工业使用和在巴西境内销售, 除用于科学研究、技术研究和产品研发外。不管是国产还是进口药品中出现的原料药,必须按照RDC 57 进行注册。 4. 为什么ANVISA 要原料药进行注册 原料药IFA注册为了更好地管控在巴西境内生产用的原料药产品。ANVISA需要获得产品的DMF文件、合成路线、生产和质量控制、产品再注册对产品的影响、产品的有效性和安全性, 统一步骤和决策,让药品注册中原料药部分更加合理化。 5. 哪些产品需要注册 按照 IN no 15/2009 e na IN no 3/2013 法, 有30余个原料药需要注册, 名单见本站链接 6. 谁可以提交注册申请? 注册原料药的公司,需要满足以下条件之一: 拥有商业化原料药许可的公司; 巴西本土原料药生产企业; 原料药进口公司执照; 药品进口商,公业务含原料药进口 7. 用于出口用途的原料药需要注册吗? 否。如果生产的药品用于出口,原料药注册时非必需的。 8. 如果某个公司注册了某原料药,其他公司进口还需要注册吗? 是的,所有进口公司都必须有一个注册证。但是可以从某个进口商处购买原料药,无需获得一个注册证。 9. 如果要注册一个药品,他的原料药也必须注册吗? 是的。但是原料药注册不是成品药注册的一部分。 原料药和成品药需要分开注册,各自走自己的审批路径。 但是原料药可以先于成品药注册。 10. 如果原料药注册取消,如何注册成品药,或者反过来如何操作? 因为原料药注册不是药品注册的一部分,因此药品注册注销不影响原料药注册。 注册成品药时, 所使用的原料药须经过注册。 因此,当原料药注册取消后,生产企业需要注册另外一家原料药生厂商,才能继续生产该药品。 11. 注册原料药时需要提交中间体或者起始物吗? 否。 但是我们建议这些内容体现在提交的文件中,证明使用的起始物或者中间体 (体现在原料药生产、杂质控制和化学结构),或简单展示产品的生产过程,而这些要求是ANVISA的原料药协会COIFA所需要的。 12: 如果某公司只做最后一步,比如精制, 可以只做这一步的注册码? 否。注册所需的文件,包括GMP的注册,需要提交从起始物直到原料药最后一步的过程, 尽管这些步骤由多个企业完成,也需要提供。 13. 植物来源的原料药需要注册吗? 否。 暂时还无需注册。但是原料药生产需要符合GMP的要求,符合 ANVISA的RDC69/2014办法。 14. 如何注册一个不再巴西药物通用名目录中的原料药Denominação Comum Brasileira (DCB)?
需要找ANVISA的RDC 96/2005办法,提交到巴西药典委员会Comissão da Farmacopeia Brasileira
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033