欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
生物药物 - 分类与特性
- 质量标准研究依据
- 质量标准及检测方法
- 方法学验证
- 问题与展望
   生物药物:质量标准及其检定方法研究依据 国内法规: 生物药物:质量标准及其检定方法研究依据 国内法规: - 《中国药典》
- 《药品注册管理办法》附件3(生物制品注册分类:治疗用生物制品)
- 《人用重组DNA产品质量控制技术指导原则》
- 《人用单克隆抗体质量控制技术指导原则》
- 《人基因治疗研究和制剂质量控制技术指导原则》
- 《人体细胞治疗研究和制剂质量控制技术指导原则》
- 《变态反应原(变应原)制品质量控制技术指导原则》
- 《药品生产质量管理规范》
- 《进口药品注册检验指导原则》
参考国际法规:
美国食品药品管理局(FDA)、药品注册的国际协调组织(ICH)等颁布的指导性法规和文件、欧洲及美国药典等。 质量标准—新版药典相关要求     方法学验证 —— 实验室:检定方法的来源与建立1.经过验证的方法 方法学验证 —— 实验室:检定方法的来源与建立1.经过验证的方法
是指已经被多家实验室进行了广泛的研究,或指政府部门或国际组织(WHO、国家药品管理当局或药典)要求各级检定实验室使用的方法,这些方法在被确定为正式方法以前,已经过了适当的验证,如《中国药典》方法。
2.来自参考文献的方法
是指在专业杂志或书籍上发表并介绍的方法,一般要认真对待这类方法,这类方法往往比较适合检测某种制品,但在应用于同类制品或其它产品时需要进行彻底的验证。3.新建立的方法
指为了提高检测灵敏度或为了达到某一特定要求而开发的或对原方法进行了修改的方法,这类方法需要进行严格的验证。
如果某实验室需要采用已经过彻底验证的标准方法或正式方法,在首次应用于测定新制品新剂型前需要进行验证以确保实验操作达到了检定要求。如果采用新开发的或修改了的方法作为常规检定方法,需要按规定进行一系列必要的方法学验证。 方法验证: 不同测定方法应进行验证的参数 生物药物检测方法验证、转移应考虑其特殊性 生物药物检测方法验证、转移应考虑其特殊性
1. 生物学活性:是反映生物药物质量的重要指标,通常使用细胞或动物进行测定,误差相对较大。不同批细胞、血清、或其它易变性物质对测定方法的准确度和精密性均有影响。
2. 生物药物多为生物大分子药物,具有分子量大、结构多样性和可变性等特点,结构的细微变化可影响药物的活性和质量。
3.对酸、碱、高温、冻融等不稳定,保存、运输条件不当会影响药品质量,并可能导致方法验证、转移困难或失败。
4.标准物质:活性标准品、含量标准品、对照品,根据情况可能分别制备,保存、运输条件相对较高,需对其稳定性进行认真分析与评价。
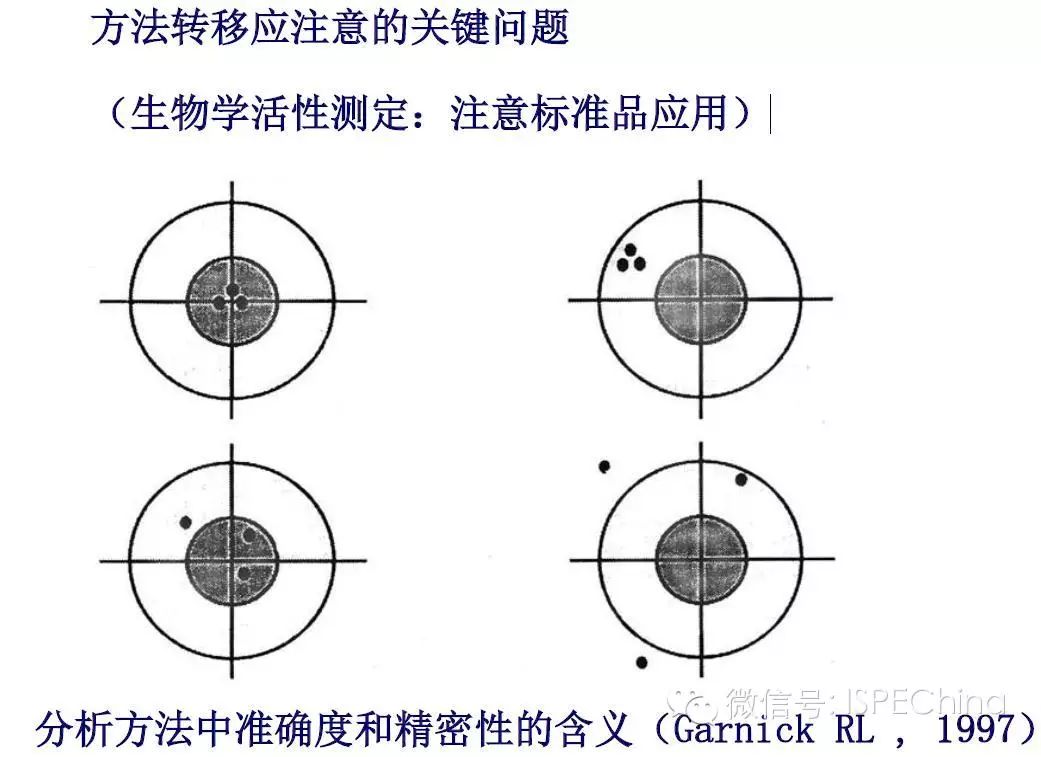 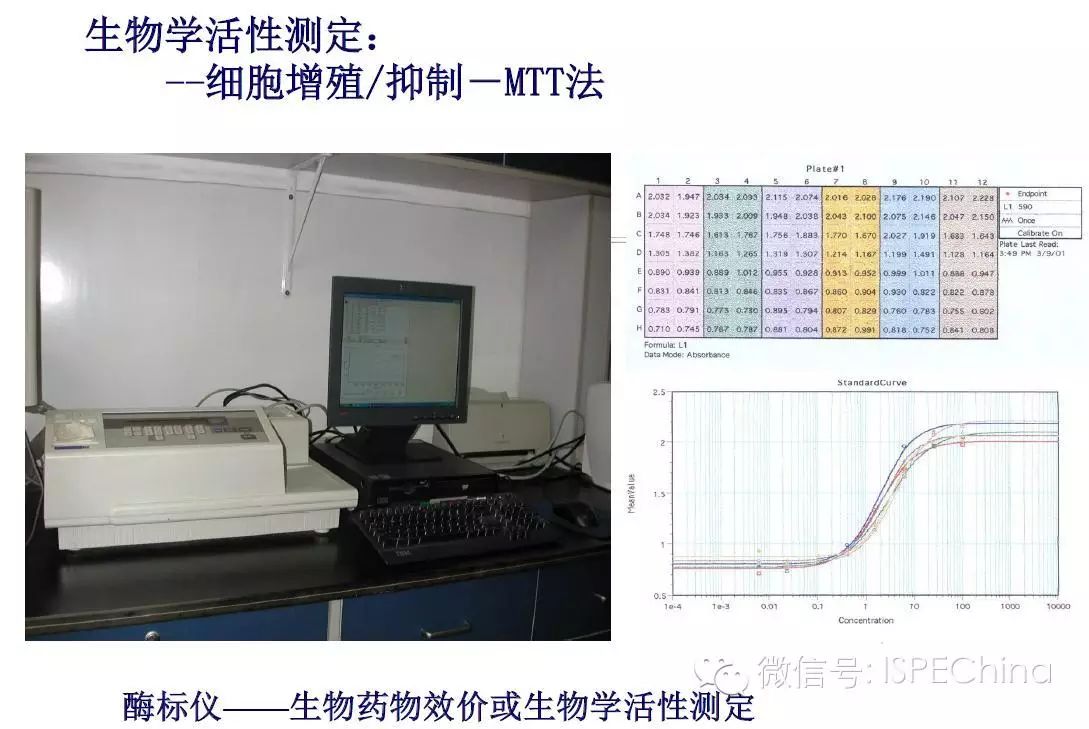  如生物学活性测定结果偏离预期值超过3倍,即供试品与标准品曲线相差一个稀释度以上,应调整预稀释倍数进行复试,尽可能使标准品和供试品剂量反应曲线趋于重叠,可得到比较准确的结果报告基因法(转基因细胞株)测定IFN活性的原理 如生物学活性测定结果偏离预期值超过3倍,即供试品与标准品曲线相差一个稀释度以上,应调整预稀释倍数进行复试,尽可能使标准品和供试品剂量反应曲线趋于重叠,可得到比较准确的结果报告基因法(转基因细胞株)测定IFN活性的原理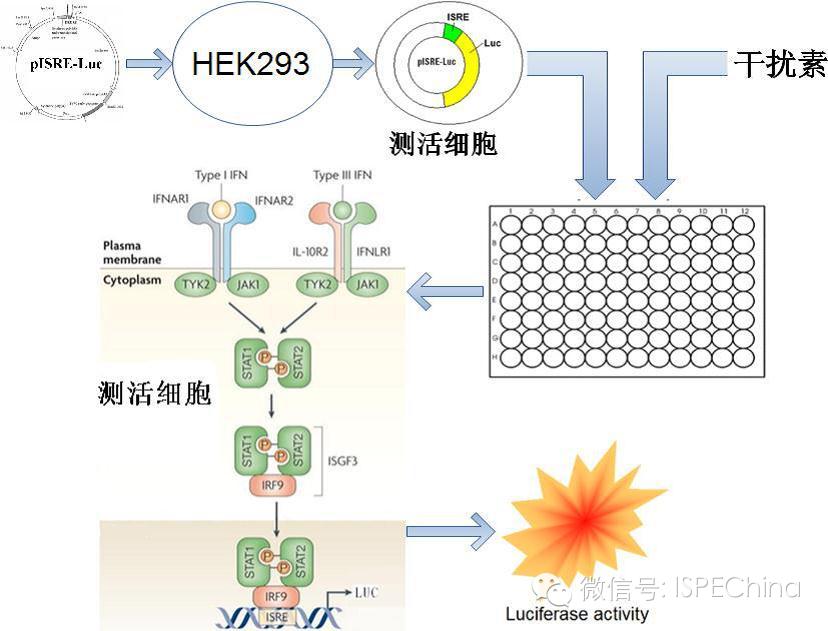 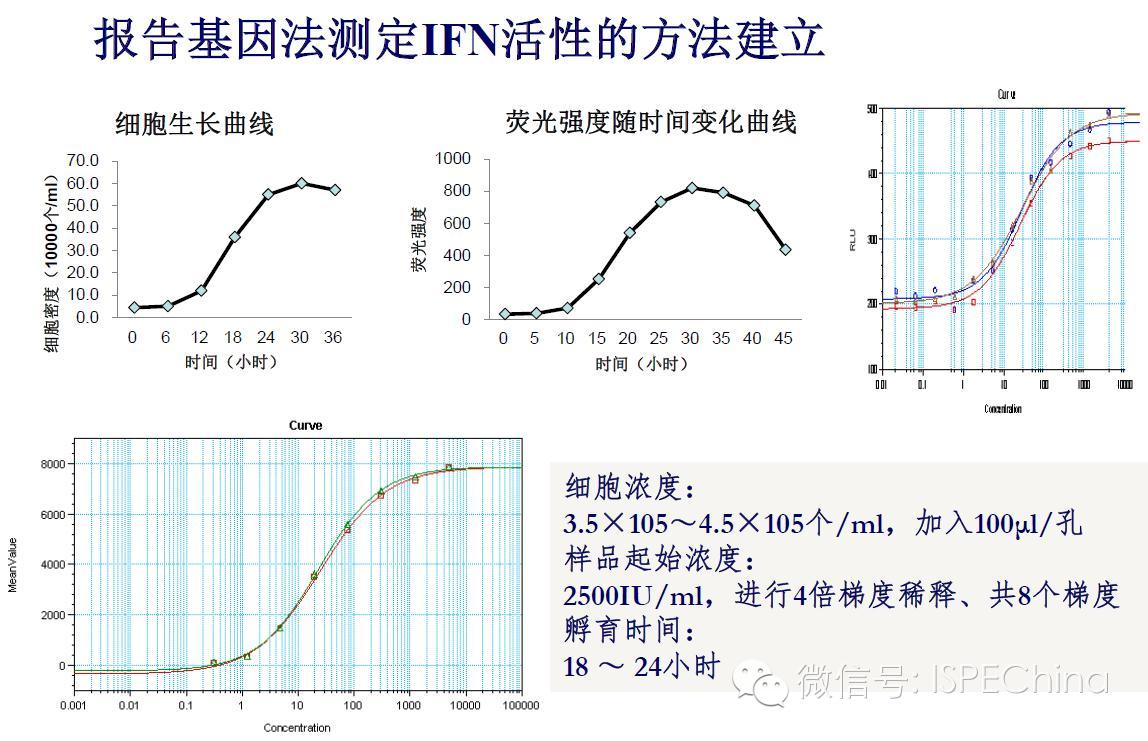 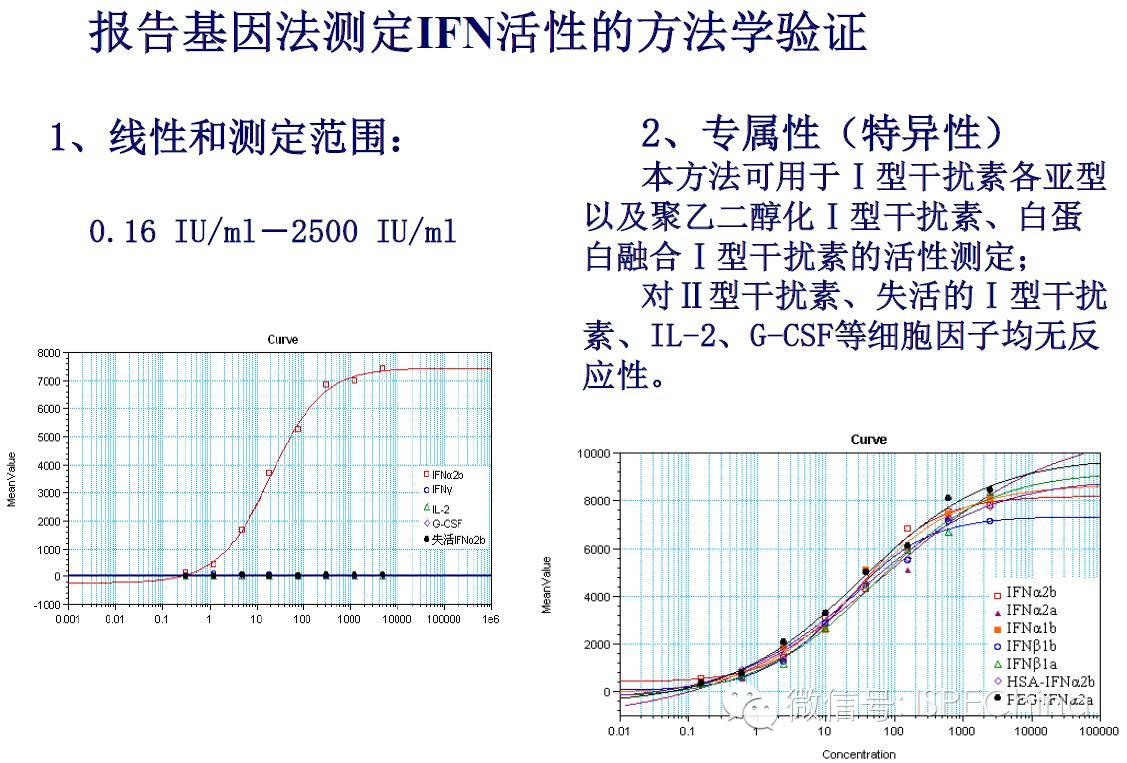 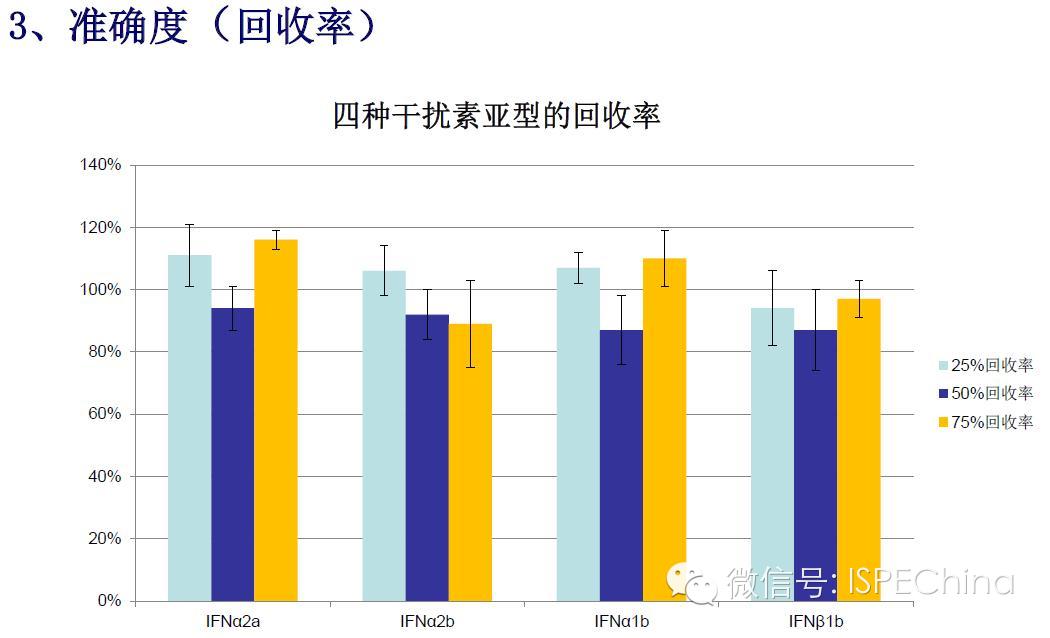 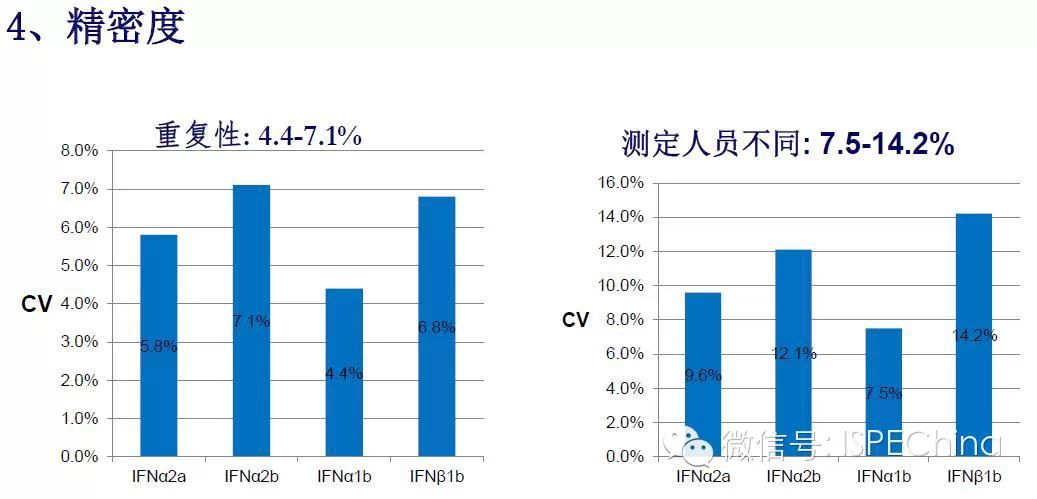 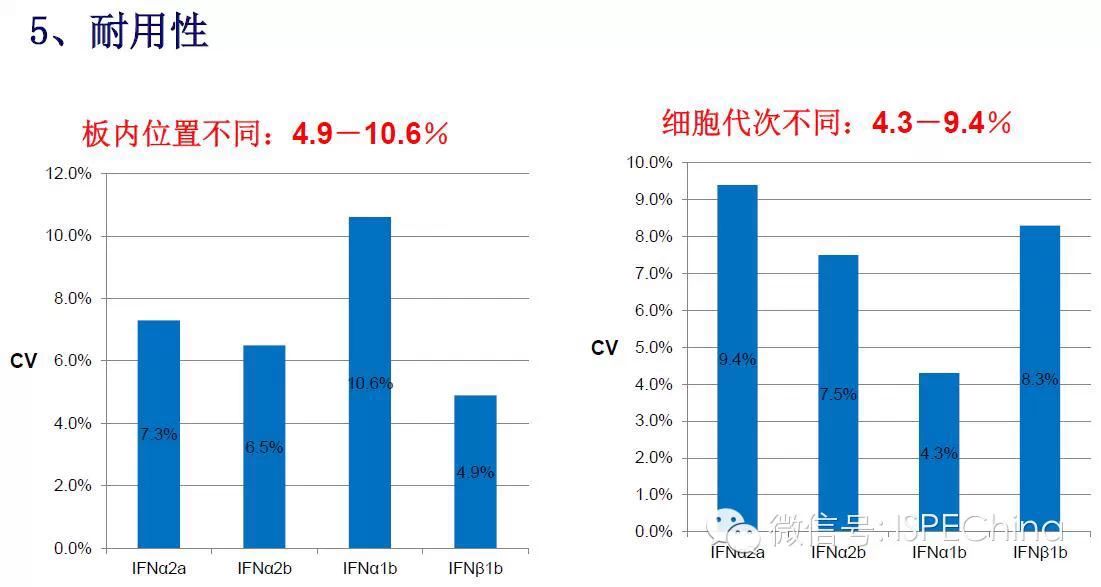  (未完待续)Speaker:饶春明 Company:中国食品药品检定研究院想要了解更多生物药物相关知识?ISPE生物制药研讨会等您来参加! 研讨会将利用2天的时间讨论:生物仿制药指导原则;中国药典的相关问题;中国生物仿制药和生物创新药研发的关键技术挑战;临床和法规的考虑以及生物仿制药研发的案例学习。 时间:11月30日-12月2日 地点:珠海 咨询及报名热线:021-23123640 (未完待续)Speaker:饶春明 Company:中国食品药品检定研究院想要了解更多生物药物相关知识?ISPE生物制药研讨会等您来参加! 研讨会将利用2天的时间讨论:生物仿制药指导原则;中国药典的相关问题;中国生物仿制药和生物创新药研发的关键技术挑战;临床和法规的考虑以及生物仿制药研发的案例学习。 时间:11月30日-12月2日 地点:珠海 咨询及报名热线:021-23123640
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033