欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
5W(Who, What, When, Where 和 Why)是制药质量体系中广泛使用的典型工具。例如,在进行偏差描述时,通过5W工具可以实现精准的偏差描述。
开展新领域的工作时,第一步总是充满挑战,计算机化系统验证(CSV)也不例外。在正式开始系统验证之前,准确识别验证范围是至关重要的第一步。它不仅能帮助我们理解验证的必要性,还能让我们提前规划和准备验证所需的各项资源,并据此制定合适的目标。
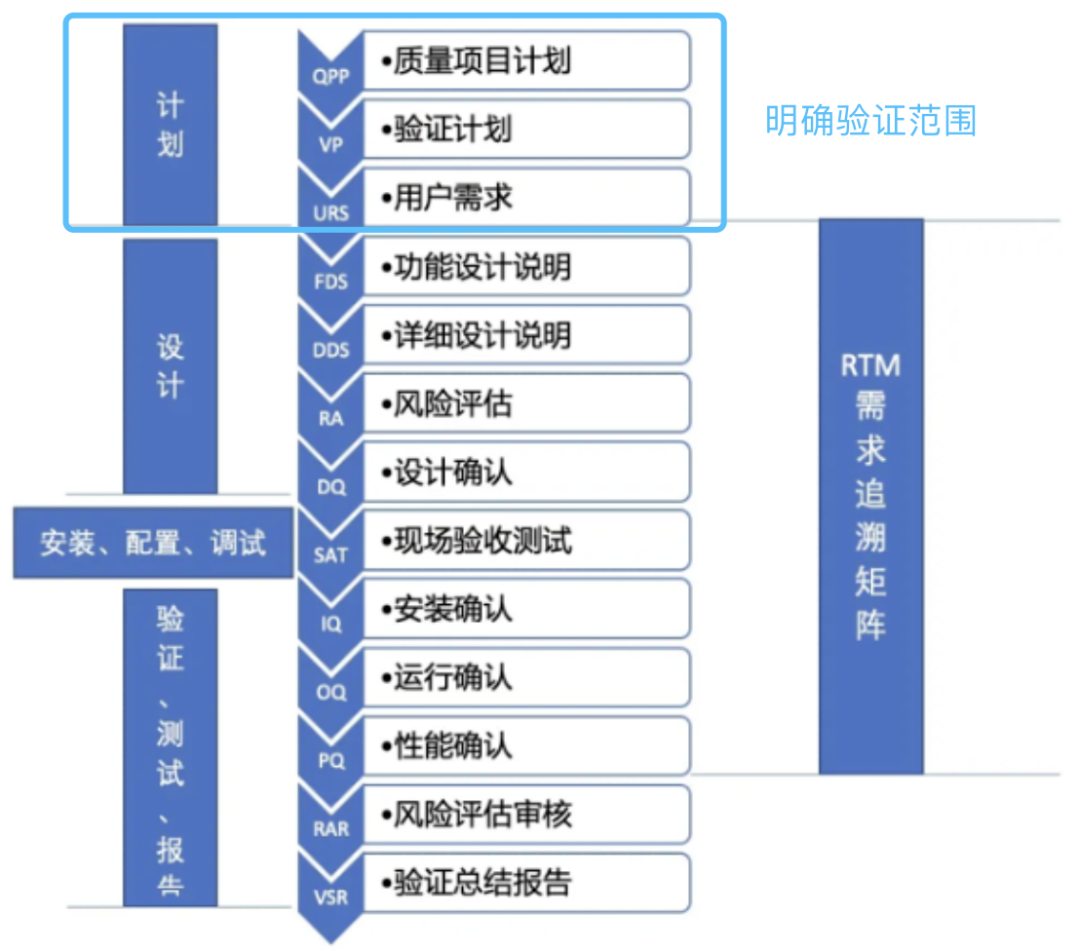
图1 计算机化系统验证流程
本期gempex德恩咨询专家靳鹏涛老师将介绍如何利用5W工具确定“计算机化系统验证范围”,从而确保验证工作的每一步是可控且符合实际情况。
1. WHO:相关人员的识别
开展系统验证时,我们需要明确“谁”是系统相关的人员。人员通常包括:
直接用户:需要直接对系统进行操作、数据输入的人员,例如生产车间人员使用MES系统,分析人员使用LIMS系统。
间接用户:需要访问系统做数据审核,但不直接在系统中输入数据的人员。例如随着数据完整性和数据审核要求的提高,越来越多的系统(色谱数据管理系统、生产自动化系统等)需要QA人员定期执行数据审核。不同层级的管理人员并不需要在系统中开展操作,但可能需要访问权限,进行对应管理层级的数据分析。
系统验证人员:每个公司组织架构和资源不同,可能安排不同部门的人员负责系统验证,例如QA验证组,CSV主题专家、业务部门人员、IT人员等,或者委托供应商/服务商完成。无论由谁负责验证,在这个阶段需要识别出这些人员。对于业务功能相关的测试执行,建议由对应的“直接用户”来完成,因为他们熟悉系统操作,能确保符合预期用途。
技术支持人员:验证过程中很多活动涉及技术支持,例如系统设计活动和技术类测试活动的开展。技术支持人员可能包括供应商人员、公司内部IT人员、电气化/自动化工程师等。他们对整个验证活动进行技术支持。
培训人员: GMP活动需要“有资质”的人员开展。CSV项目实施过程中的培训是确保人员资质的重要活动,包括系统功能、运维的培训和验证相关文件的培训。CSV项目的实施需要识别出相关的培训执行人员和培训参与人员,尤其是对于大型系统,涉及集团总部和多个工厂的情况,每个地点都应有代表人员参与。
2. WHAT:系统功能和需求的识别
在这个问题中,我们需要识别出,CSV中关于“什么”这些问题的答案。这里需要考虑:
系统用途:系统用于什么目的,产生哪些数据,对产品质量、患者安全、数据可靠性的影响是什么。
系统运行方式:系统是单独运行的,还是涉及其它对接的系统?如果是后者,系统接口的需求是什么,系统和验证的边界如何划分。
学习难度:系统的学习难度如何,从而确定培训的程度。
相关文件:需要的相关文件有哪些,通常包括系统操作文件、备份与恢复相关文件、系统安全与权限控制文件等。
总体计划:需要建立一个系统的计划,支持CSV活动的开展。
3. WHEN:时间规划
在规划执行计划时,有时间做计划是至关重要的。这里需要识别出以下关键时间:
4. WHERE:地点确定
在这里我们需要确定项目实施的一些关键地点:
系统安装地点:一些大型系统构成比较复杂,除了机房安装的服务器和其它基础设施,还可能包括在各业务部门安装的组件,例如涉及多个厂房的PCS系统。有的公司可能采用云服务器部署一些关键系统,有的系统可能适用不同城市的不同工厂。因此,系统安装在哪里这个问题没有统一答案,但必须在具体验证时有明确答案,并配备相应资源。
测试执行地点:验证过程可能设计多轮次的测试,例如单元测试、集成测试、FAT、SAT测试等。大型系统的安装可能涉及多个地点,每个安装地点的测试也需要考虑。
5. WHY:验证目的
系统为什么要进行验证?
减少人为差错:在GMP领域,人为因素被视为很大的不稳定因素,例如人员不小心写错了数据、人员没有按照SOP要求进行操作、人员引入的洁净区污染等。因此越来越多的计算机化系统正在被使用,以降低人为差错。
节约成本:在计算机化系统建设过程中可能会出现各种人员导致的问题,如硬件的错误、软件的bug等。系统验证是一套科学的流程,通过对过程步骤的良好把控,可以早发现问题早解决问题,确保系统符合预期用途。如果不开展验证活动,系统建成后发现问题,可能导致更高的更改的成本,甚至造成业务和经济损失。从这个角度来说,系统验证也为企业节约了成本。
理解验证的意义,有助于参与者提高主动性和执行力。
德恩咨询计算机化系统专家
靳鹏涛老师 CS合规负责人 制药工程学士,拥有近15年的行业背景。曾任职于大型上市药企,在GMP符合性、CS计算机化系统管理与验证、质量管理方面和电子数据管理积累了丰富的经验和深厚的专业知识。
专注于GMP合规性管理与执行,特别是在CS合规性。在gempex德恩咨询期间主导及实施60+个GMP符合性项目,包括差距分析、模拟检查、CS体系搭建,自动化生产系统验证,4类及5类软件的验证、CS生命周期管理培训、电子签名及电子记录符合项目、数据完整性分析等。
曾主导过多项复杂CS全球合规性验证项目,如ERP、WMS、DMS、MES等;为多家企业搭建了完善的验证文件体系,涵盖验证计划、风险评估、设计确认及性能确认等各个环节;作为主审计员和共同审计员参与超过20个第三方审计项目。执行项目覆盖FDA、EU、NMPA、WHO及PIC/S等多种法规要求。
专长于医药行业CS全球cGMP符合性、CS管理与验证、质量体系搭建、培训以及数据完整性、数据风险评估和电子数据管理等。
以上是德恩咨询对如何利用5W确定CSV范围的分享。如果您喜欢,请将本文章转发给更多人吧~
如果您对计算机化系统合规性方面有其他感兴趣的话题或者疑问,欢迎在下方留言,我们专家将随机挑选话题作为下一次文章的主题。
P.S. 本文章为gempex德恩咨询原创。如需转载,请注明来源于gempex德恩咨询。
欢迎垂询 服务热线:400-166-2002
关于gempex德恩咨询 德恩咨询是gempex在中国的全资子公司,是具有国际影响力的GMP咨询与执行机构,致力于为全球的生命科学企业提供合规、高效及可执行的GMP解决方案。经过22年的发展,我们拥有60多位经验丰富的GMP专家,全球累计执行项目超过5000个,累计为1000多个客户提供专业服务,业务遍布20多个国家,并与众多知名药企建立了长期的合作关系。
我们的专家团队拥有丰富的行业经验,熟知NMPA、FDA、EU、WHO、ICH、PIC/S、MHRA、SWISSMEDIC、TGA等GMP法规要求,能为不同国家和地区的客户提供定制化的解决方案,服务包括全球GMP符合性、新厂房合规性、CS计算机化系统、工厂质量管理和多国MAH/MAA服务。
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033