欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
gempex德恩咨询的专家在做项目的时候经常遇到GMP方面的咨询,本期我们挑选其中一个热门话题——GMP变更,在此解答其中关于变更中容易被忽略的问题:
关键人员的调整算不算是GMP的变更,是否可以不用走变更控制程序?组织架构的调整又算GMP的变更吗?
接下来跟着小编一起寻找答案吧!
一. GMP变更的定义
首先,我们先来了解什么是GMP变更。
在法规方面,没有GMP变更的直接定义,只有对GMP变更控制或者变更管理的定义,比如: 欧盟 GMP 指南的附件 15 将变更控制定义为:“A formal system by which qualified representatives of appropriate disciplines review proposed or actual changes that might affect the validated status of facilities, systems, equipment or processes.” 译文:“一个由相关部门有资质的代表人员对可能影响设施、系统、设备或者流程的验证状态的提议或实际的变更进行审核的正式系统。”
基于官方的定义我们可以从里面把变更的定义抽提出来。即 “A modification which may impact the current approved status of product, process, method, equipment, system or procedure.” 所以变更是对产品、工艺、方法、设备、系统或规程等可能影响当前已批准状态进行的更改。
二. 人员和组织架构调整方面的要求
我们先来看一下官方法规指南对人员和组织架构方面的要求。
EU方面
1. EU GMP Part II (ICH Q7) (其中Part I 未提及)
 译文:书面程序应规定对原材料、质量标准、分析方法、设施、支持系统、设备(包括计算机硬件)、工艺步骤、标签和包装材料以及计算机软件的变更进行识别、记录、适当的审核和批准。
小结:这里没有举出明确人员和组织架构方面的调整需要执行变更程序。
2. Commission Directive 2003/94/EC  译文: 负责实施执行GMP的管理和监督人员,包括质量受权人,其职责都应在工作描述中加以规定。其层级关系应在组织架构图中进行界定。组织架构图和工作描述应按照生产企业的内部程序批准。
小结:这里明确包含关键人员和组织架构的要求。
3. European Commission 2013/C 223/01 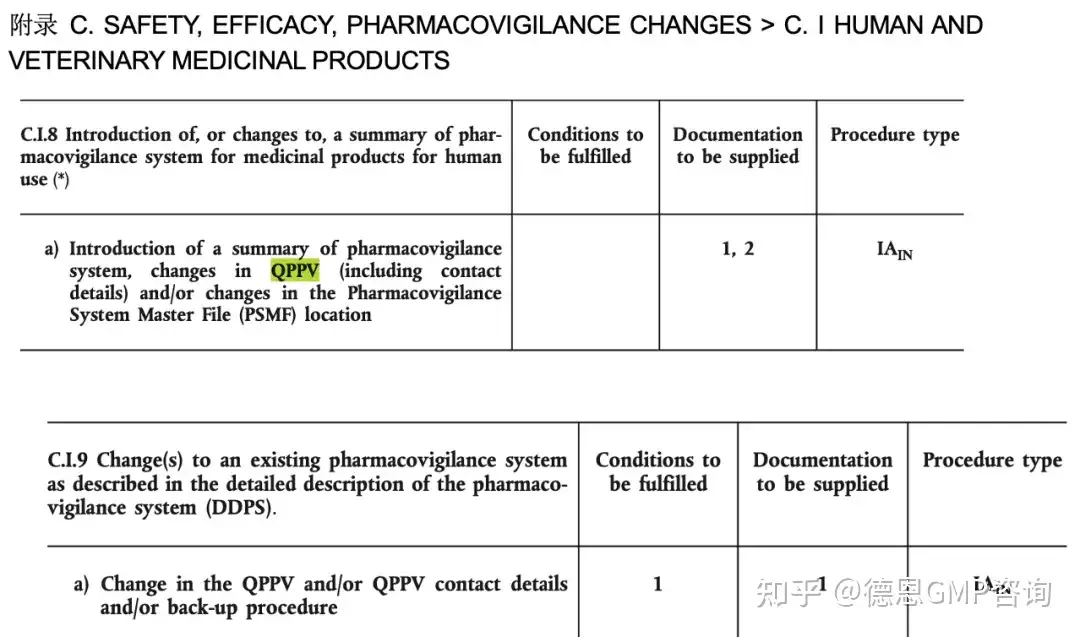
小结:以上没有明确说明组织架构和关键人员需要执行变更,但是至少QPPV的调整是应当要进行变更的。
US方面
1. US 21 CFR Part 820
(其中Part 211并未提及变更的范围)
 译文: (b)文件变更。除非另有特别指定,文件的变更应由执行原始审核和批准的同一职能或组织的个人进行审核和批准。批准的变更应及时传达给对应的人员。每个生产企业应保存文件变更的记录。变更记录应包括变更的描述、受影响文件的编号、批准人员的签字、批准日期和变更生效的时间。  译文: (b)生产和工艺变化。每个生产企业应为质量标准、方法、工艺或流程的变更建立程序并进行维护。这些变更在实施前应根据820.75章节进行确认或者适当时验证,并记录在案。变更应按照820.40章节进行批准。
小结:以上并没有针对人员和组织架构的内容。因此也可以看出美国法规方面没有明确说明人员和组织架构方面的调整是否需要做变更的要求。
CN方面
1. 《药品生产质量管理规范》(2010年修订) 
小结:从这里可以看出,中国GMP也没有明确说明人员和组织架构方面的调整是否需要做变更的要求。
总结 除了无菌附录/指南(CN, EU, US)里提到人员有重大变更要执行培养基模拟灌装这个特例之外,中美欧的GMP正文都没有明确要求关键人员、组织架构的调整需要执行“变更控制”,但EU有要求组织架构和高层管理人员的工作职责要批准,也有EU指南提到部分关键人员需要变更。
以上中美欧代表性的法规没有明确指出关键人员、组织架构的调整需要进行变更,但是为什么会存在组织架构、关键人员调整要变更的说法呢?有依据吗?
单从中国来讲,这种说法是存在的,我们看以下法规的说明:
1. 《药品生产监督管理办法》(2020)  
2.《药品上市后变更管理办法》(2021) 
3. 《药品年度报告管理规定》(2022) 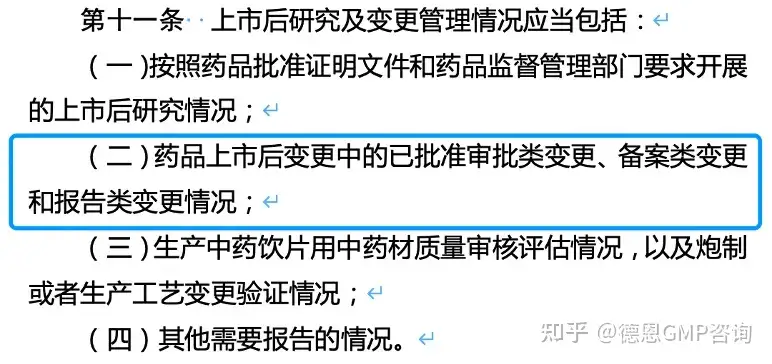
总结 从这三个法规方面来看,如果属于生产监管事项方面的,那么关键人员和组织架构的调整是需要变更的。
因此,对于组织架构和关键人员的调整,在中美欧的GMP里规定是一致的,没有明确要求按变更来管理的。EU指南有提到部分的关键人员要执行变更。
在中国,药品监督管理办法以及其他法规有明确的要求,因此,还是需要按变更来进行管理。对于US和EU如果有其他更明确的规定,欢迎在评论区分享哦~
END
关于德恩咨询 德恩咨询是gempex在中国的全资子公司,是具有国际影响力的GMP咨询与执行机构,致力于为全球的生命科学企业提供合规、高效及可执行的GMP解决方案。经过22年的发展,我们拥有60多位经验丰富的GMP专家,全球累计执行项目超过5000个,累计为1000多个客户提供专业服务,业务遍布20多个国家,并与众多知名药企建立了长期的合作关系。 我们的专家团队拥有丰富的行业经验,熟知NMPA、FDA、EU、WHO、ICH、PIC/S、MHRA、SWISSMEDIC、TGA等GMP法规要求,能为不同国家和地区的客户提供定制化的解决方案,服务包括全球GMP符合性、新厂房合规性、CS计算机化系统、工厂质量管理和多国MAH/MAA服务。 我们始终秉承德国总部的高标准和专业精神,坚持为客户提供高质量的服务,确保能够在满足GMP规范的同时,帮助客户建立起一套长期有效的质量管理体系,实现企业可持续发展,是您值得信赖的GMP专家。
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033