欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
这个eSTAR发布也有一年半了,我们也好几个项目按这个形式交,今天来总结一下吧。 FDA将定期启动试点计划,以帮助提高510(k)审查的一致性和效率。这些试点项目旨在帮助行业和FDA的工作人员有效利用资源。这使得FDA能够将更多的精力放在对高风险设备的审查上,这有助于减少决策的总时间,并促进510(k)审查的一致性。 定义解释: eCopy:在光盘(CD)、数字视频光盘(DVD)或U盘上创建并提交的医疗器械资料的电子版本。 eSubmitter:一个包含电子提交模板的免费FDA软件。 Electronic Submission Template and Resource (eSTAR):提交者用于准备医疗器械提交的PDF电提交模板 eSTAR Pilot Program eSTAR是是自愿使用的。用于指导上市前通知(510(k))提交者完成准备综合医疗设备510(k)提交的过程。 此模板可以:自动化(例如,表单构建、自动填充);补充CDRH内部审核模板的内容和结构;整合多种资源(如指南、数据库);每个提交部分的指导施工;和自动验证(即,美国食品和药物管理局不打算进行RTA) eSTAR试点项目始于2020年2月27日。到目前为止,FDA已经选出了九名参与者,他们代表了医疗器械行业的总体情况。 eSTAR与eSubmitter的不同: eSTAR的设计和结构与FDA 510(k)审查者的智能模板类似,包括一系列问题、文本、逻辑和提示,指导用户准备510(k)提交。此外,eSTAR应用程序的功能和内容嵌入在一个PDF中,这将使行业在开发、查看和编辑510(k)时更加灵活。 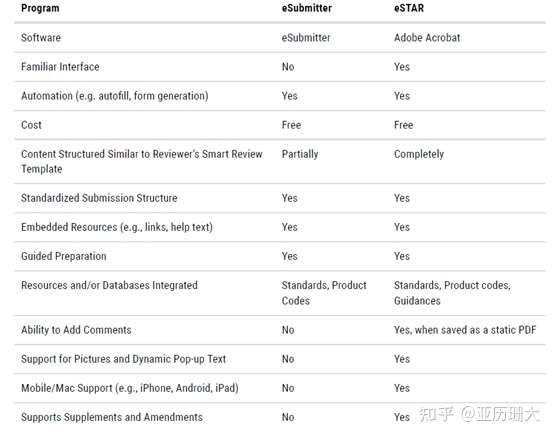 如何准备eSTAR 官网上下载模板 现在放几张eSTAR的PDF,看下具体是怎么操作的。 [img=658,461][/img]" data-caption="" data-size="normal" data-rawwidth="658" data-rawheight="461" class="origin_image zh-lightbox-thumb lazy" width="658" data-original="https://pic3.zhimg.com/v2-d5b5e5eb3faf82f1acd24769dc5cc10e_r.jpg" data-actualsrc="https://pic3.zhimg.com/v2-d5b5e5eb3faf82f1acd24769dc5cc10e_b.jpg" style="display: block; max-width: 100%; margin-right: auto; margin-left: auto; cursor: zoom-in;">确实非常方便,并且里面的各个地方都有介绍和提示。填完的地方用绿色 表示,没填的地方用红色表示。针对不同性质的产品,在选择特性后整个模板也会相应的更新。正确完成 eSTAR 文件后,顶部的状态消息将显示“eSTAR Complete”。 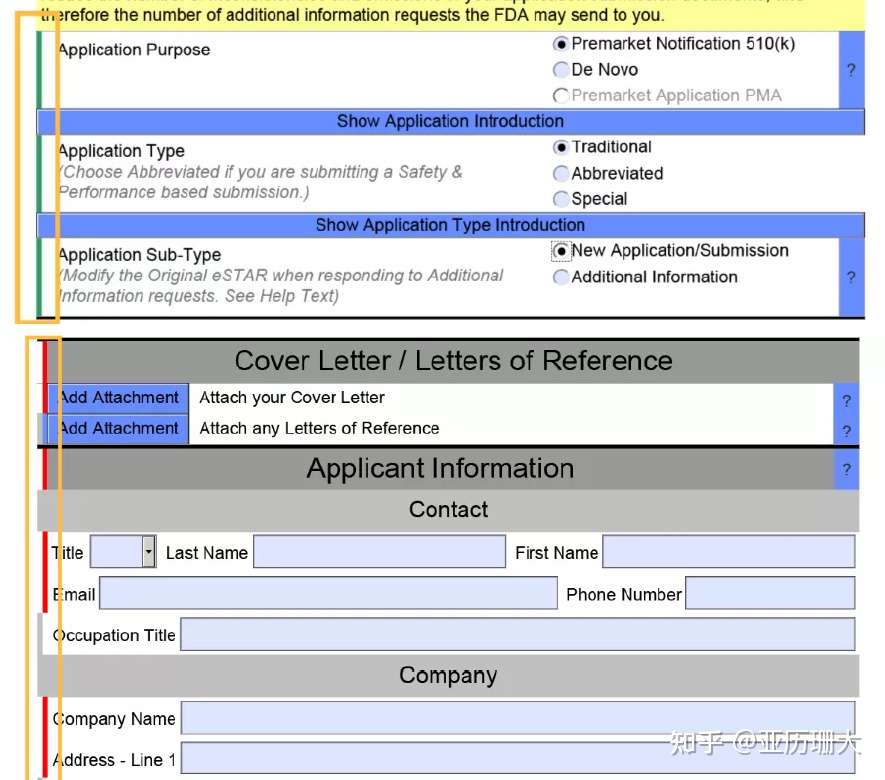
如何在eSTAR下提交510k 如果您正在参加自愿的eSTAR试点计划,您提交的材料应包括: l 带有eSTAR PDF l 给文件控制中心(DCC)的打印cover letter。 例如,在这个试点项目中,一个可接受的提交包将包括一个打印好的附信,该附信附有一个包含按eSTAR格式的u盘 按eSTAR准备就不用再遵循ecopy。 对于补充资料AI怎么回复 在eSTAR“申请/提交类型”的第一部分指出提交是一个补充在您指明补充信息后,将会出现一个附加部分,提供对附加信息请求的响应。 Quality in 510(k) Review Program Pilot 2018年9月6日,FDA启动了510(k)质量审查计划试点,旨在简化制造商使用电子提交软件提交某些510(k)通知的方式。试点的目标是确定使用eSubmitter是否会产生组织良好的提交,以便美国食品和药物管理局的工作人员更有效地审查。 该试验成功地产生组织良好的提交。然而,随着eSTAR的创建,FDA确定了使用eSTAR而不是eSubmitter进行提交的额外好处。 2021年5月30日之后,FDA将不再接受510(k)审查文件中的质量。公司应该考虑使用eSTAR。 目标是FDA在收到合格的510(k)后60天内做出最终决定。 符合510(k) Review Program Pilot的影响因素有哪些? 设备必须满足以下所有因素,才有资格参加510(k)质量审查计划试点: 1.该设备的主要产品代码如下表所示。FDA已经确定了一个符合该试点的产品代码列表。这些设备类型属于中度风险,被认为是FDA所熟知的。 2.该装置不是组合产品(如药物装置或生物装置组合)。 3.该设备的牵头中心是美国食品和药物管理局的设备和放射健康中心(CDRH)。 4.提交的材料是用电子提交模板“CDRH:非体外诊断装置- 510(k)”构建的。 如果不满足上述任何因素,提交者将不得不使用传统方法向文件控制中心提交有效的eCopy。如果提交者试图使用电子提交器为不符合资格因素的产品提交510(k)申请,将因无效的电子副本而被拒绝。 如何为510(k)审核计划试点中的质量准备一个510(k)? 510(k)作为510(k)质量审查计划试点的一部分提交,必须使用名为“CDRH:非体外诊断装置- 510(k)”的eSubmitter进行构建提交者不应使用“体外诊断装置- 510(k)”。 eSubmitter要求的信息与传统510(k)中通常要求的信息相同。构建完成后,eSubmitter会将提交内容格式化为一个压缩文件(电子提交包)。再复制到光盘,DVD或u盘。 必须在Cover Letter中写明是适用于510(k) Review Program Pilot。 如何提交? 邮寄 审核时间? 不再进行RTA。作为510(k)质量审查计划试点的一部分,FDA将在收到510(k)后60天内做出最终决定。 注意:如果510(k)被发现不符合510(k)审查计划试点的质量标准,美国食品和药物管理局将通过电子邮件向510(k)的官方联系人通知此决定以及审查无法在60天内完成的原因。然后510(k)将根据标准程序使用传统的90天时间框架进行审查。 | Regulation | Product code | Description | 870.1250 Percutaneous
catheter | DQY | Percutaneous Catheter
(only for cardiovascular and peripheral indications) | 870.1310 Vessel dilator
for percutaneous catheterization | DRE | Vessel Dilators | 870.1340 Catheter
introducer | DYB | Catheter Introducer | 870.1650 Angiographic
injector and syringe | DXT | Angiographic Syringes | 870.1650 Angiographic
injector and syringe | MAV | Syringe, Balloon
Inflation | | 870.1875 Stethoscope | DQD | Electronic Stethoscope | 870.2900 Patient
transducer and electrode cable (including connector) | DSA | Cable, Transducer And
Electrode, Patient, (Including Connector) | | 870.4450 Vascular clamp | DXC | Vascular Clamps | 870.4885 External vein
stripper | MGZ | Valvutome | 870.5800 Compressible
limb sleeve | JOW | Compressible limb
sleeve | | 874.1050 Audiometer | EWO | Audiometer | 874.3400 Tinnitus
masker | KLW | Tinnitus masker | 876.1500 Endoscope and
accessories | FTI | Lamp, endoscope,
incandescent | 876.1500 Endoscope and
accessories | GCJ | Laparoscope, General
& Plastic Surgery | 876.1500 Endoscope and
accessories | OCZ | Endoscopic
grasping/cutting instrument, non-powered | 876.4500 Mechanical
lithotripter | FGK | Tripsor, stone, bladder | 878.4810 Laser surgical
instrument for use in general and plastic surgery and in dermatology | GEX | Powered laser surgical
instrument | 880.2910 Clinical
electronic thermometer | FLL | Electronic thermometer | | 880.5570 Hypodermic single lumen needle | FMI | Hypodermic single lumen needle | 882.1320 Cutaneous
electrode | GXY | Cutaneous electrode | 886.1120 Ophthalmic
camera | HKI | Ophthalmic camera, AC powered | | 886.1780 Retinoscope | HKL | Retinoscope, Ac-Powered | 886.1850 AC-powered
slitlamp biomicroscope | HJO | Biomicroscope,
Slit-Lamp, Ac-Powered | | 886.4370 Keratome | HMY | Keratome,
Battery-Powered | | 886.4370 Keratome | HNO | Keratome, Ac-Powered | 886.4670 Phacofragmentation
system | HQC | Unit,
Phacofragmentation | | 886.5700 Eyelid weight | MML | Weights, Eyelid,
External | 886.5928 Soft
(hydrophilic) contact lens care products | LRX | Case, Contact Lens | 888.3030
Single/multiple component metallic bone fixation appliances and accessories | LRN | Surgical wire | 888.3030
Single/multiple component metallic bone fixation appliances and accessories | LYT | Fixation accessory | 888.3050 Spinal
interlaminal fixation orthosis | NQW | Orthosis, Spine, Plate,
Laminoplasty, Metal | 890.3850 Mechanical
wheelchair | IOR | Mechanical wheelchair | | 890.5500 Infrared lamp | OAP | Laser, comb, hair | 890.5650 Powered
inflatable tube massager | IRP | Massager, powered
inflatable tube | 892.1000 Magnetic
resonance diagnostic device | MOS | Coil, magnetic
resonance, specialty | 892.1680 Stationary
x-ray system | MQB | Solid state x-ray
imager (flat panel/digital imager | 892.2050 Picture
archiving and communications system | PGY | Display, diagnostic
radiology | | unclassified | LXQ | Cup, Eye | | unclassified | OKS | Lacrimal Stents and
Intubation Sets |
这是对FDA官网的内容自己的理解,大家可以指点指点我的不足之处,谢谢!
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033