50家药企将接受现场检查!
12月2日,国家药监局药品审核查验中心发布了两则现场检查任务信息公告。

公告内容中显示:接到药品审评中心根据《药品注册管理办法》(市场监管总局令第27号)第48条规定启动的64个药品注册申请的药学研制和生产现场核查任务,梳理发现,共计50家药企将接受检查,其中3家药企为一致性评价检查,另外47家全部为药品注册现场检查。
将接受检查的企业名单包括浙江智达药业有限公司、浙江瑞邦药业股份有限公司、浙江金华康恩贝生物制药有限公司、河南比福制药股份有限公司、云鹏医药集团有限公司、石家庄五岳制药厂、江苏豪森药业集团有限公司、烟台东诚药业集团股份有限公司、山东盛迪医药有限公司、湖南恒生制药股份有限公司、上海恒瑞医药有限公司、广州大光制药有限公司、浙江众延医药科技有限公司、甘李药业股份有限公司、杭州中美华东制药有限公司、兰州生物制品研究所有限责任公司等知名企业。
其中重庆圣华曦药业股份有限公司、健康元药业集团股份有限公司、南京柯菲平制药有限公司、瑞阳制药股份有限公司、广州朗圣药业有限公司、合肥立方制药股份有限公司、吉林省辉南长龙生化药业股份有限公司、四川百利药业有限责任公司、浙江诺得药业有限公司、四川汇宇制药股份有限公司、四川科瑞德制药股份有限公司、西安葛蓝新通制药有限公司、广西强寿药业集团有限公司、苏州二叶制药有限公司、海南万玮制药有限公司、江苏柯菲平医药股份有限公司、河北常山生化药业股份有限公司、四川成都同道堂制药有限责任公司因为已收到现场核查申请,中心提醒这些企业不必重复提交。现附上完整名单:
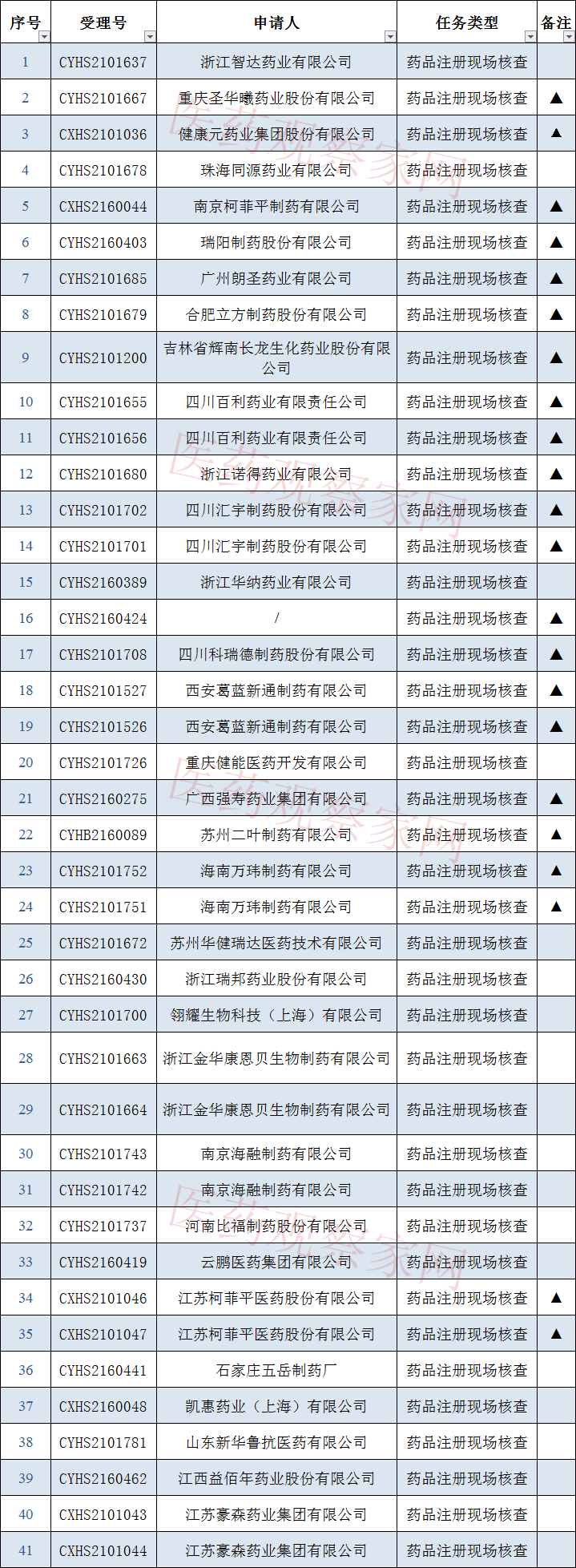
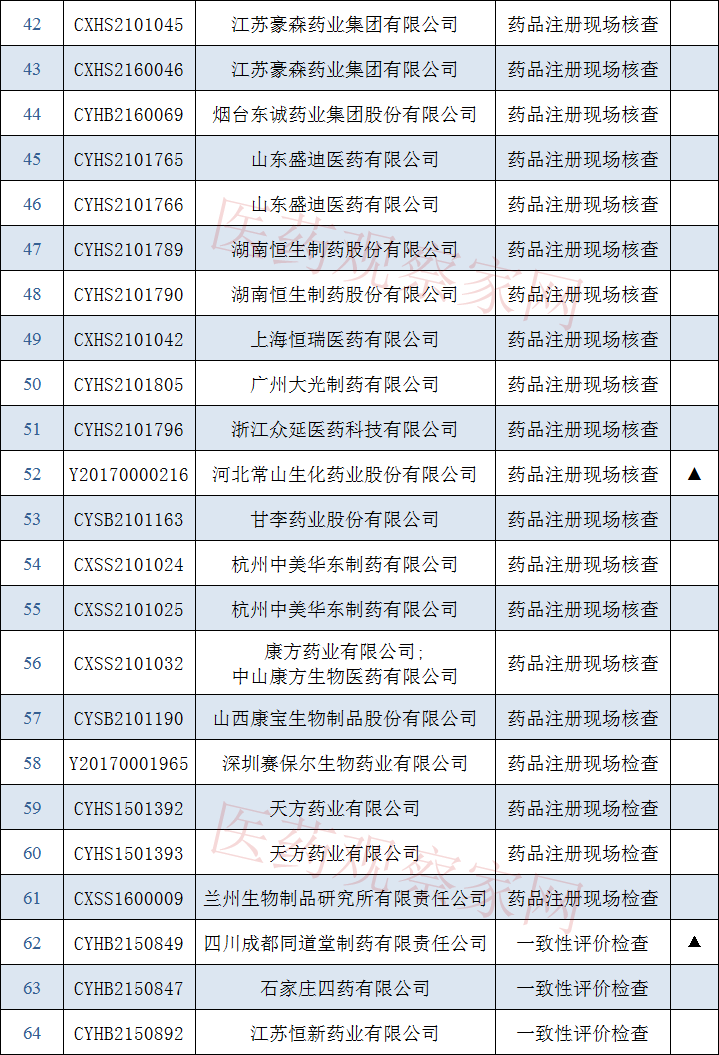
根据原《药品注册管理办法》(国家食品药品监督管理局局令第28号),已接收到药品审评中心相关申请生产现场检查通知文件的注册申请人,且自认为具备接受现场核查条件的,需在规定时间内登陆中心网站(www.cfdi.org.cn),通过“药品注册申请人之窗”提交药品注册申请生产现场检查的申请。中心将根据药品注册申请人可以接受现场检查的时间等安排,组织现场检查工作,其中优先审评品种予以优先安排。请相关药品注册申请人予以关注,逾期不提交,中心将按照有关规定终结相关检查任务,并回复药品审评中心。
近来接受药品注册检查的情况不少,这是一个非常好的征兆;代表我国医药行业正在飞速发展,各大研发龙头为了抢占市场也在加紧布局创新药和仿制药的研究、试验,相信中国医药的未来前途无限!
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/dk8ZrHf0bQfaTw1DGN4Xuw)



