QC主任工作过多!GMP缺陷!
2022年01月17日,辽宁药监局发布生产企业检查公示,共计3家药品生产企业接受检查,发现缺陷8条。
具体内容如下:

01
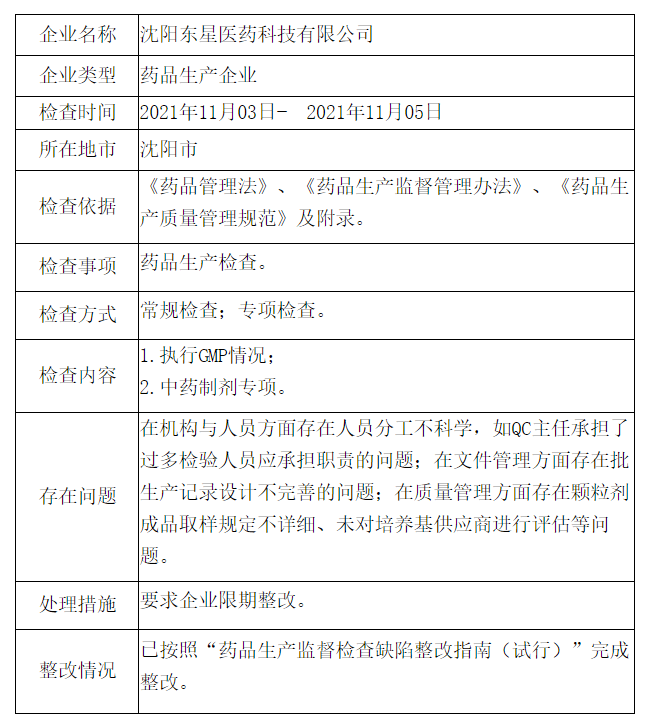
存在问题:
在机构与人员方面存在人员分工不科学,如QC主任承担了过多检验人员应承担职责的问题;
在文件管理方面存在批生产记录设计不完善的问题;
在质量管理方面存在颗粒剂成品取样规定不详细、未对培养基供应商进行评估等问题。
02
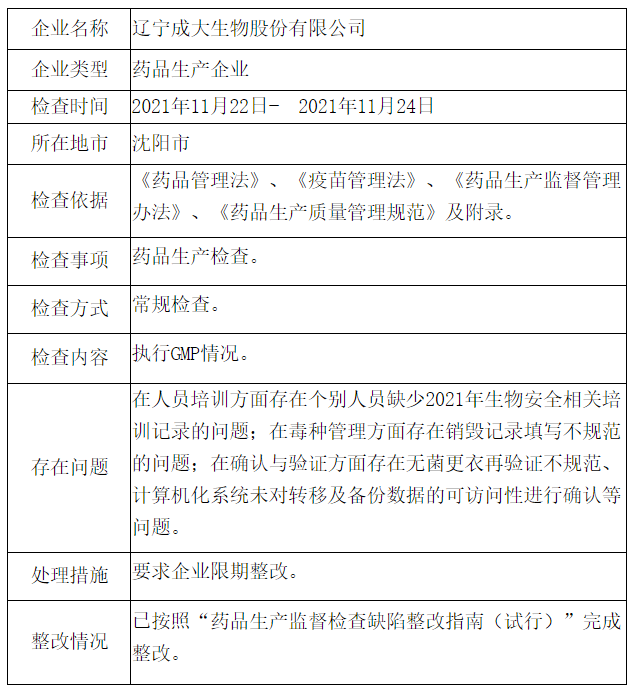
存在问题:
在人员培训方面存在个别人员缺少2021年生物安全相关培训记录的问题;
在毒种管理方面存在销毁记录填写不规范的问题;
在确认与验证方面存在无菌更衣再验证不规范、计算机化系统未对转移及备份数据的可访问性进行确认等问题。
03
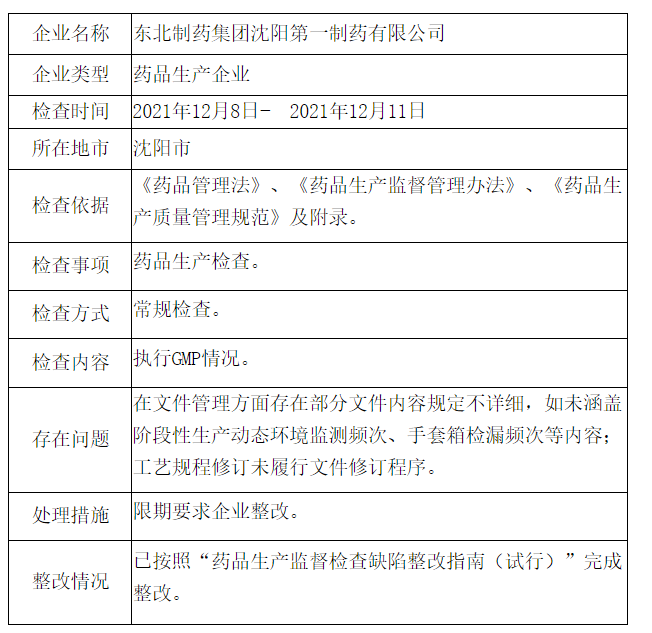
存在问题:
在文件管理方面存在部分文件内容规定不详细,如未涵盖阶段性生产动态环境监测频次、手套箱检漏频次等内容;
工艺规程修订未履行文件修订程序。
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/NSNVcZEXs9sQZZXA9PBxlQ)



