2年内5笔license out,生物类似药出海成风,是出路吗?
9月8日,百奥泰宣布与Sandoz(山德士)达成授权许可和商业化协议,将其BAT1706(贝伐珠单抗生物类似药)在美国、欧洲、加拿大和大部分其他BAT1706合作未覆盖的国际市场的排他产品商业化权益有偿许可给山德士。
该交易首付款及里程碑款总金额最高至1.55亿美元,其中包括2750万美元首付款、累计不超过 1.275 亿美元里程碑付款和两位数百分比的利润分成。
在此之前,就贝伐珠单抗百奥泰与百济神州、巴西的Biomm及海外的CiplaLimited公司签订了商业合作协议。至此,百奥泰贝伐珠单抗绝大部分市场的权益都实现了对外授权。
2020年来,百奥泰已经完成了5笔关于生物类似药的License out交易,累计金额高达6亿美元,授权范围覆盖欧洲和美国。在创新药License out交易盛行的今天,生物类似药的License out交易为何活跃起来?是什么企业在买中国的生物类似药?各家药企的策略都是什么?
01 百奥泰生物类似药出海
贝伐珠单抗是罗氏的“三驾马车”之一,适应证覆盖了非小细胞肺癌、转移性结直肠癌、胶质瘤、肾细胞癌、宫颈癌和上皮性卵巢癌、输卵管癌或原发性腹膜癌在内的多种恶性肿瘤。2018年全球销售额70亿美元,位列全球最畅销药物榜第七位。
广泛的适应证及联用潜力让制药企业对其青睐有加。而百奥泰对贝伐珠单抗的商业化似乎有点“敬而远之”,“倒也不是百奥泰不做商业化,他们的阿达木单抗自己在做,每个产品是保留权益还是寻找机会,一要符合战略二要算一笔经济账。”有接近百奥泰的人士分析。
此前5月绿叶制药子公司博安生物也将其贝伐珠单抗在中国大陆地区21个省市及自治区县域市场的独家推广权交给了阿斯利康。一番操作后,贝伐珠单抗的国内竞争者将是阿斯利康、齐鲁、恒瑞、绿叶、百济、信达,压力不言而喻。
无独有偶,2020年以来百奥泰完成了5笔生物类似药的License out交易,交易对象不乏百济、Biogen、山德士这种大药企,其BD的业绩在整个行业都可圈可点。
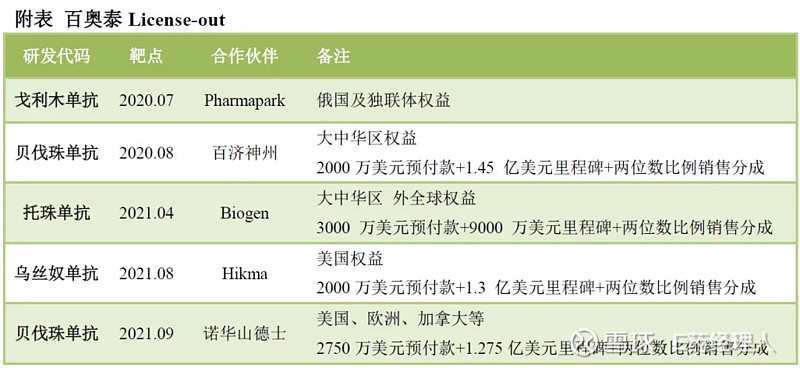
值得关注的是,4款License out产品中有3个是自身免疫疾病用药,包括戈利木单抗、托珠单抗、乌司奴单抗。目前,这三款产品均保留了大中华区的权益,百奥泰唯一一款商业化的产品阿达木单抗生物类似药(商品名:格乐立)也是一款自身免疫用药。
据了解,格乐立自2020年1月起开始进行商业销售,截至今年半年报百奥泰现销售团队成员约240余人。目前,该公司是以自营分销模式为主导,以代理销售模式为辅助的模式在进行商业化。截至半年报,百奥泰来自药品部分的销售收入为1.22亿元,另有接近六成收入来自授权许可收入,为1.91亿元。
目前,百奥泰已经形成了以肿瘤、自身免疫疾病为主,以心血管疾病、眼科疾病为辅的产品管线,包括16个临床阶段的产品,4个临床前阶段产品。其中6款自免产品全部进入临床,5个属于生物类似药;肿瘤产品除贝伐珠单抗外其余皆为临床3期前的新药。所以从管线上,不保留贝伐珠单抗主要商业化权益,更能理解了。
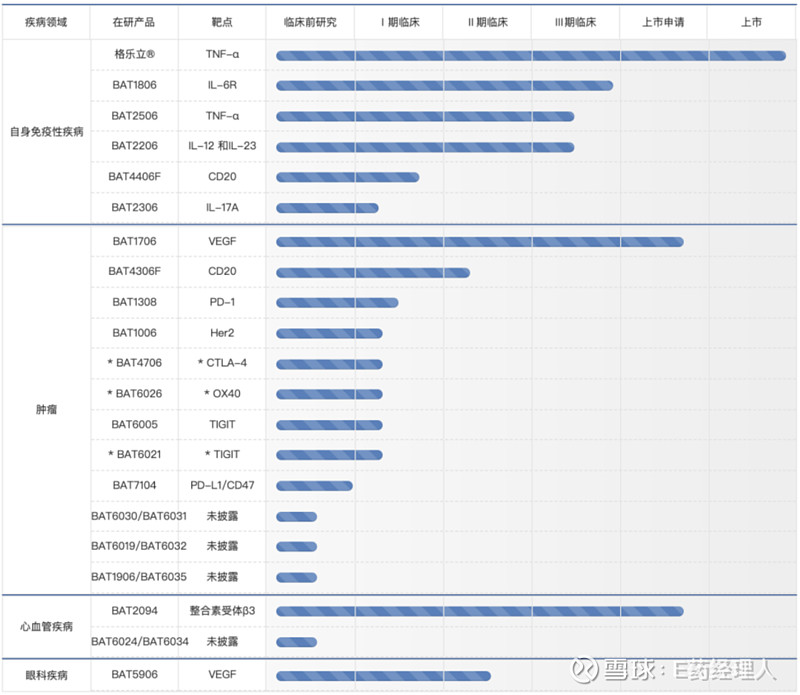
百奥泰产品管线
“以自身免疫生物类似药切入商业化,再扩充至肿瘤药”是百奥泰选择的“近道”,或许对于没有商业化基础的Biotech来说,不失为一种合适的选择。回顾百奥泰的发展历程,这是一家对战略高度把握并能及时调整的公司,包括其在生物类似药领域的布局,包括做出Her2 ADC、Trop2 ADC、PD-1三个产品临床终止的选择。
而且生物类似药能否出海还取决于很多条件,譬如刚开始Global的定位,明确开发路径,举个例子,俄罗斯要求你的产品临床有多少比例的患者是俄罗斯人,日本也是,之后产品是否能够同时满足中美欧三地的质量标准等等。
02 “山德士们”为何从中国买?
作为仿制药和生物类似药的巨头,山德士为何要从中国License in生物类似药的管线呢?
前述人士分析,山德士的收购可能有几方面的原因:一是他们自己也在做,但进度上慢了一些。二是自身的管线在推进中可能遇到一些问题。三是可能根本就没有立项,就是希望通过引进的方式更快的购买一个。
早在1996年,山德士便开始研发生物类似药,目前已经拥有8种已上市产品。多年来,它开创了生物类似药领域的多个“第一”,包括欧洲第一款生物类似药——2006年的重组人生长激素(Omnitrope)、美国第一款生物类似药——2015 年的 Zarxio等。2018年,美国也FDA接受了公司的阿达木单抗(adalimumab,商品名:修美乐)生物类似物的生物制品许可申请。
尽管如此,可面对着梯瓦等仿制药巨头和众多MNCs在生物类似药领域的竞争,山德士也急切需要扩充管线,以保住其市场地位。
早在2016年时,公司就提出一项激进的监管提交战略,计划在3年时间提交11个生物类似药的监管申请。2018年,公司又宣布与印度的生物医药公司Biocon建立全球合作伙伴关系,共同开发、生产和销售免疫学和肿瘤学领域的多种生物类似药。
山德士首席执行官Richard Francis曾表示,此举是为了巩固山德士在生物类似药领域的领导者地位,并使它们能够在未来继续保持领先。而在去年,山德士大中华区总裁Francis Vaillant首次透露,山德士也有将生物类似药引入中国的远期规划。
除了此次百奥泰与山德士的合作。美国生物制药公司Coherus BioSciences与信达生物的海外授权合作也是一个典型案例。
2020年1月,Coherus宣布以4500万美元的首付款、里程碑付款以及双位数的销售分成,拿下了信达的贝伐珠单抗生物类似药的美国和加拿大商业化权益,主要就是看中了这款生物类似药与旗下UDENYCA可以形成互补。
作为一种与生物专利药高度相似的生物制品,生物类似药的概念于2006年由欧盟率先提出,此后,WHO、韩国、日本和美国都相继发布了相关的技术要求,并打通了生物类似药在规范医药市场环境中的上市之路。
第一代生物类似药主要聚焦相对简单的分子,如生长激素epoetins和filgrastims等等。2013年,欧美批准了第一款单抗克隆体生物类似药,2015年,美国首款生物类似药也正式获批。自此,生物类似药在全球迅速被点燃,市场增速远超原研生物药,沙利文预计,2030年,全球生物类似药市场将达到1644亿美元。
过去十年,全球生物类似药开发商数量大幅增加,尤其是在亚洲和拉丁美洲等经济体,呈现出强劲的后发优势,根据汤森路透的数据显示,中国生物类似药研发管线数量已经跃居全球第一。作为中国医药创新的突破口之一,国内生物类似药市场在监管、支付、人才等多措并举的刺激下,近年来正呈现出爆发式增长。
截至目前,中国在生物类似药上布局的企业超过180家,其中,最具代表性的除了百奥泰,还有复宏汉霖、信达生物、齐鲁制药、正大天晴、绿叶制药、科兴制药等等。根据沙利文的报告预计,2021年,中国生物类似药的市场规模将达到113亿元,2030年市场总规模将达到589亿元,年复合增长率将达到20.14%。
毫无疑问,随着中国生物类似药的竞争力日渐走强,出海已经成为了众多头部药企的不二选择,与此同时,随着国际创新药研发合作通道被打开,越来越多的跨国药企开始选择将中国作为生物类似药引进原产地。
03 生物类似药,谁在出海?
选择授权出海的国内生物类似药企业,不只百奥泰一家。
目前国内共有7家11款生物类似药获批上市,主要集中在利妥昔单抗、曲妥珠单抗、阿达木单抗和贝伐珠单抗四种药物。
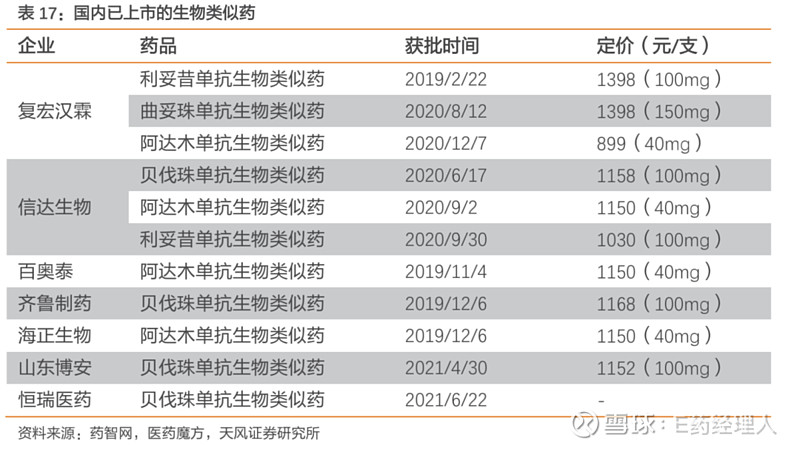
其中,复宏汉霖和信达生物获批数量最多,两家企业也都选择了授权出海的策略。
国内第一款生物类似药就来自复宏汉霖。复宏汉霖的利妥昔单抗在2017年10月向国家药监局递交上市申请,是国内第一个报产的单抗生物类似药,最终在2019年2月获批。
早在上市之前,2018年,复宏汉霖便将刚刚被被药品审评中心纳入优先审评程序的利妥昔单抗在阿根廷、巴拉圭、乌拉圭、玻利维亚等部分南美新兴国家市场的开发和商业权益独家授给了阿根廷生物药企Biosidus。
上市是10月后,复宏汉霖又与制药企业FARMA DE COLOMBIA达成协议,将利妥昔单抗在哥伦比亚、秘鲁、厄瓜多尔、委内瑞拉的独家许可和商业化权利授予了出去。
复宏汉霖另一款生物类似药曲妥珠单抗,出海之路走得则更早也更为彻底。
2020年,复宏汉霖的曲妥珠单抗先后在欧洲和中国两地获批上市。2017年复宏汉霖便与雅各臣药业达成合作协议,授予其在中国香港及中国澳门的独家商业化权利;2018年授予Accord在欧洲、中东、北非及独联体的70余个国家独家商业化许可;其在亚太和拉丁美洲地区部分新兴国家市场的开发和商业化则独家授权给了印度仿制药巨头Cipla。
Accord在全球拥有7000到8000种仿制药在售,商业化能力强势。2020年9月曲妥珠单抗上市后,Accord 又以2700万美元首付款,每5亿美元净销售额2500万美元的销售里程碑追加了美国、加拿大的独家商业化权利。
通过向多家企业对外授权多个产品、多个地区的商业化权利,复宏汉霖快速实现了生物类似药在全球的商业化布局。一方是美国、欧盟等发达国家市场,一方则是“一带一路”周边国家以及南美国家等新兴市场。复宏汉霖在2020年中报中表示将寻求更多的国际伙伴的合作,进一步推动核心产品进入更广阔的国际市场。
根据复宏汉霖最新财报,2021年上半年利妥昔单抗授权许可收入约为520万元,曲妥珠单抗在欧盟则实现收入2670万元,同时实现原液销售收入1100万元。
信达生物也有一款生物类似药选择通过授权的方式出海。
2020年1月,信达生物宣布与 Coherus 达成合作协议,授予其生物类似药贝伐珠单抗在美国和加拿大的商业化权益。协议规定Coherus向支付信达支付4500万美元首付款和里程碑付款,以及双位数比例的销售分成。
国内市场贝伐珠单抗生物类似药竞争异常激烈。齐鲁制药在2019年拿下贝伐珠单抗的首仿,并于2019年与原研药一起进入国家医保目录。信达生物第二个获批上市,虽然动作迅速。但后继者来时更凶。目前国内共有四家获批上市,另有4家公司已经提交了NDA。相比看似过热的国内市场,进军类似药市场潜力大大增加的美国市场不失为开疆辟土的方法之一。
IQVIA在一份报告中就曾指出,以印度和中国药企为主的生物医药企业,将寻找机会使他们的生物制剂达到出口标准,并主要通过准入合作关系,打开市场,开展业务,其成本将比西方和大型跨国公司低很多。虽然这些公司的产品并不是对所有人都有有吸引力,但是他们有机会在几乎没有竞争压力的情况下进入市场,从而获得更高的溢价。
除了竞争还有政策的影响。
2015年出台的《生物类似药研发与评价技术指导原则(试行)》对生物类似药的申报程序、临床试验的开展、注册类别等相关方面做了详细的规范;2017年出台的《生物制品通用名命名原则规程》进一步促进了生物制品的标准化和规范化,将我国生物制品与国际接轨。今年2月18日,国家药品监督管理局药品审评中心发布了《生物类似药相似性评价和适应症外推技术指导原则》,该指导原则自发布之日起实施,意味着我国对生物类似药产品研发、上市提出了明确的监管要求。生物类似药监管水平的提高提高了国产生物类似药的准入标准,为出海创造了条件。
不过,虽然生物类似药出海趋势愈发明显,但数据显示,在中国生物类似药上布局的近180家企业里更多的还是未出海的公司。
齐鲁制药获批第一款生物类似药之后就并未选择出海。但凭借强大的销售能力,2020年上市第1年齐鲁的贝伐珠单抗大卖18亿元,仅用一年多的时间,便冲上了百床大院的前十大用药榜单,MAT同比增长率达到792.7%。
选择不出海的还有海正药业。据海正药业2020年度网上业绩说明会上的回答,2019年获批国内第二款阿达木单抗生物类似药首年实现了2亿多元的销售额。
2021年5月,绿叶制药子公司博安生物研发的贝伐珠单抗生物类似药正式获,成为国内第三款贝伐珠单抗生物类似药。与信达的出海和齐鲁、海正自产自销的模式都不同,博安生物将其中国大陆地区21个省市及自治区县域市场的独家推广权益许可给了阿斯利康。
就目前而言,出海与否说到底是各家生物类似药企业的战略不同并无优劣高低。不过,在可预见的带量采购实施背景下,生物类似药的市场迅速紧缩,以往的高利润市场不复存在,出海或许会成为更多企业的选择。
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://xueqiu.com/3483303916/197280504)



